| CATEGORII DOCUMENTE |
| Bulgara | Ceha slovaca | Croata | Engleza | Estona | Finlandeza | Franceza |
| Germana | Italiana | Letona | Lituaniana | Maghiara | Olandeza | Poloneza |
| Sarba | Slovena | Spaniola | Suedeza | Turca | Ucraineana |
DOCUMENTE SIMILARE |
|
Einführung
Ein weiteres Versuchsziel ist die Bestimmung der Dissoziationskonstanten der verwendeten Elektrolyten Mithilfe des Oswaldschen Verdünnungsgesetzes.
Eine praktische Anwendung der Leitfähigkeitsmessung liegt zum Beispiel im Messen der Reaktionsgeschwindigkeit bei Reaktionen entweder Salze als Endprodukte gebildet oder als Ausgangsprodukte verbraucht werden, so daß sich die Leitfähigkeit in Abhängigkeit des Reaktionsfortschrittes ändert.
Beim Umweltschutz dienen Leitfähigkeitsmessungen zur Konzentrationsbestimmung eines bekannten Salzes in Abwässern. Als Beispiel für diese Möglichkeit wird die Härte von Leitungswasser als letzter Teil des Versuches bestimmt, wobei angenommen wird, daß die Härte des untersuchten Wassers nur durch CaCO3 verursacht wird.
Verwendete Gleichungen und Konstanten
Aus der Anleitung entnommen:
F *c * (v+ * v-) = k
![]()
![]()
Kohlrausches Wurzelgesetz: ![]()
![]()
Dissoziationsgrad ![]()
Ostwaldsches Verdünnungsgesetz: ![]()
Aus Schulstoff entnommen:
Mittelwert: 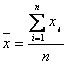 ;
; ![]() (Physik FOS, 11. Klasse)
(Physik FOS, 11. Klasse)
Beim Verdünnen von Lösungen gilt: ![]() (Chemie FOS, 12. Klasse)
(Chemie FOS, 12. Klasse)
Ionenradius für Na+
Ionen: r = 0,95 ![]() m
(Aus Chemie 1. Semester, Prof. Schwankner)
m
(Aus Chemie 1. Semester, Prof. Schwankner)
Für Regressionsgreaden gilt (Aus Physik 1. Semester; Prof. Sepp):
Steigung


Korrelationsfaktor 
Unsicherheit der Steigung:

Unsicherheit im Achsenabschnitt

Aus Dobrinski/Krakau/Vogel: Physik für Ingeneure; B. G. Teubner Stuttgart, 7. Überarbeitete und erweiterte Auflage 1988 entnommen:
Viskosität von Wasser: ![]() = 1,01 *
= 1,01 * ![]()
Aus Hammer/Hammer: Physikalische Formeln und Tabellen; J. Lindauer Verlag (Schaefer) München, 5. Auflage 1992 entnommen:
Faraday Konstante: F=9,6485 * ![]()
Elementarladung: e = 1,6022 * ![]() As
As
Versuchsbeschreibung
Teilversuch 1: Bestimmung der spezifischen Leitfähigkeit k von HCl, NaCl, Hac und NaAc:
Die vier Salzlösungen liegen in einer Konzentration von 0,1![]() vor. Mit destilliertem Wasser werden Konzentrationen von 0,01
vor. Mit destilliertem Wasser werden Konzentrationen von 0,01![]() bis 0,1
bis 0,1![]() in Schritten von 0,01
in Schritten von 0,01![]() hergestellt. Um eine Elektrolyse der Lösung zu vermeiden, wird zur
Leitfähigkeitsmessung Wechselstrom verwendet. Die Meßwerte werden in ein
Diagramm eingetragen, aus dem dann die spezifische Leitfähigkeit k ermittelt wird. Daraus wird die Summenbeweglichkeit der in den Salzen
vertretenen Ionen ermittelt. Durch Zuhilfenahme des Prinzips der unabhängigen
Ionenwanderung können Beweglichkeit, Geschwindigkeit und Ionenradius einzelner
Ionen ermittelt werden.
hergestellt. Um eine Elektrolyse der Lösung zu vermeiden, wird zur
Leitfähigkeitsmessung Wechselstrom verwendet. Die Meßwerte werden in ein
Diagramm eingetragen, aus dem dann die spezifische Leitfähigkeit k ermittelt wird. Daraus wird die Summenbeweglichkeit der in den Salzen
vertretenen Ionen ermittelt. Durch Zuhilfenahme des Prinzips der unabhängigen
Ionenwanderung können Beweglichkeit, Geschwindigkeit und Ionenradius einzelner
Ionen ermittelt werden.
Teilversuch 2: Bestimmung der Aquivalentleitfähigkeit L und der Grenzleitfähigkeit L![]()
Die Konzentration c der Salzlösungen wird auf die
Aquivalentkonzentration c‘ = c * z normiert und als ![]() gegen
gegen ![]() aufgetragen. Bei starken Elektrolyten wird die
Grenzleitfähigkeit durch Extrapolation der Regressionsgeraden bis zum
Schnittpunkt mit der L- Achse ermittelt. Für schwache
Elektrolyte benutzt man das Gesetz zur unabhängigen Ionenwanderung, um die Grenzleitfähigkeit
zu ermitteln. Sobald die Grenzleitfähigkeit bekannt ist, kann der
Dissoziationsgrad
aufgetragen. Bei starken Elektrolyten wird die
Grenzleitfähigkeit durch Extrapolation der Regressionsgeraden bis zum
Schnittpunkt mit der L- Achse ermittelt. Für schwache
Elektrolyte benutzt man das Gesetz zur unabhängigen Ionenwanderung, um die Grenzleitfähigkeit
zu ermitteln. Sobald die Grenzleitfähigkeit bekannt ist, kann der
Dissoziationsgrad ![]() sowie die Dissoziationskonstante Kc
des Ostwaldschen Verdünnungsgesetz berechnet werden.
sowie die Dissoziationskonstante Kc
des Ostwaldschen Verdünnungsgesetz berechnet werden.
Teilversuch 3: Bestimmung der Härte von Leitungswasser:
Aus der gemessenen Leitfähigkeit wird, mit Hilfe bekannter Beweglichkeiten der Ionen und der Annahme, daß nur ein Salz (Calziumcarbonat) sowohl die Wasserhärte als auch die Leitfähigkeit verursacht, die Wasserhärte über die Konzentration dieses Salzes bestimmt.
Meßergebnisse
Versuchsauswertung
Spezifische Leitfähigkeit ![]()
Berechnung der Unsicherheiten in der Konzentration der hergestellten Lösungen mit jeweils 50 ml Gesammtvolumen:
![]()
![]()

mit ![]() =
0 (laut Angabe des Betreuers) folgt:
=
0 (laut Angabe des Betreuers) folgt:
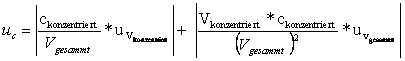
|
Hergestellte Konzentration c in |
Lösung |
Wasser |
Unsicherheit in |
|
1*5 ml |
2*20 ml + 1*5 ml | ||
|
2*5 ml |
2*20 ml | ||
|
3*5 ml |
1*20 ml + 3*5 ml | ||
|
1*20 ml |
1*20 ml + 2*5 ml | ||
|
1*20 ml + 1*5 ml |
1*20 ml + 1*5 ml | ||
|
1*20 ml + 2*5 ml |
1*20 ml | ||
|
1*20 ml + 3*5 ml |
3*5 ml | ||
|
2*20 ml |
2*5 ml | ||
|
2*20 ml + 1*5 ml |
1*5 ml | ||
|
2*20 ml + 2*5 ml |
0 ml |
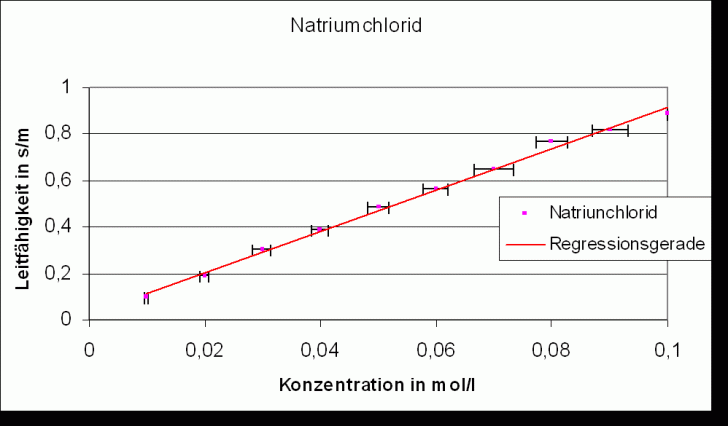
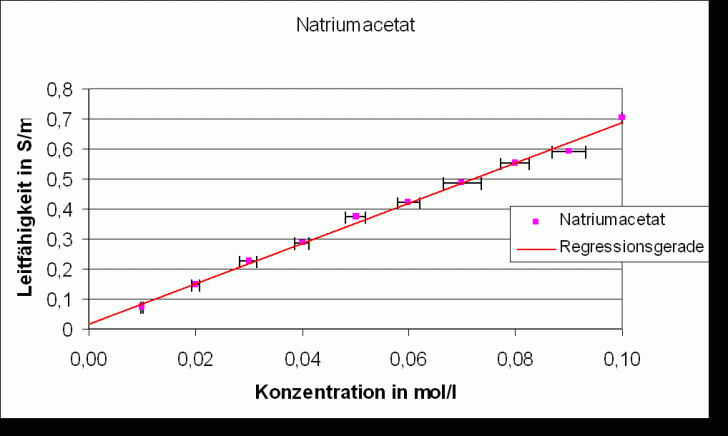
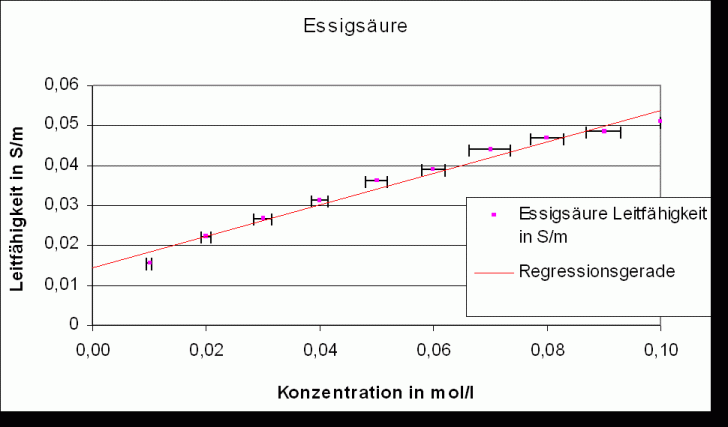
Die Regressionsgeraden folgen der Gleichung: k =a * c + b, wobei c Konzentration des gelösten Salzes ist.
Regressionsgerade:
Steigung 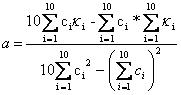
![]()

Unsicherheit der Steigung:

Unsicherheit im Achsenabschnitt
Korrelationsfaktor 
![]()
|
Spezifische Leitfähigkeit k |
Korrelationsfaktor r |
|
|
Natriumchlorid |
(8,87 | |
|
Natriumacetat |
(6,83 | |
|
Salzsäure |
(37,14 | |
|
Essigsäure |
(0,39 |
Berechnung der Summenbeweglichkeit:
k =F *c * (v+ + v-) wobei F die Faraday-Konstante ist.
k =a * c + b (Regressionsformel)
Da b annähernd 0 ist, gilt: ![]()
|
Summenbeweglichkeit (v+ + v-) |
|
|
Natriumchlorid |
(920 |
|
Natriumacetat |
(704 |
|
Salzsäure |
(3863 |
Beweglichkeit von Na+:
![]() = (240
= (240![]() 20,1)
20,1)
![]()
Geschwindigkeit von Na+:
![]() = (480
= (480![]() 40,2)
40,2)
![]()
Ionenradius von Na+:
![]()
![]() =3,5
*
=3,5
* ![]() m
m
Literaturwert : 0,95* ![]() m
m
Erklärung für den Unterschied: Das Ion kommt nur hydratisiert in der Lösung vor.
Aquivalentleitfähigkeit
![]() :
:
![]()
Auf die Berücksichtigung der Temperaturabhängigkeit von ![]() wurde verzichtet, da bei einer Temperatur von 19 C der dadurch verursachte Fehler kleiner ist als 2,5% und somit als
vernachlässigbar betrachtet wird.
wurde verzichtet, da bei einer Temperatur von 19 C der dadurch verursachte Fehler kleiner ist als 2,5% und somit als
vernachlässigbar betrachtet wird.
![]()
![]()
da uz = 0, da z die Anzahl der Elementarladungen pro Ion angiebt
![]()
|
Konzentration c
in |
|
|
|
|
|
|
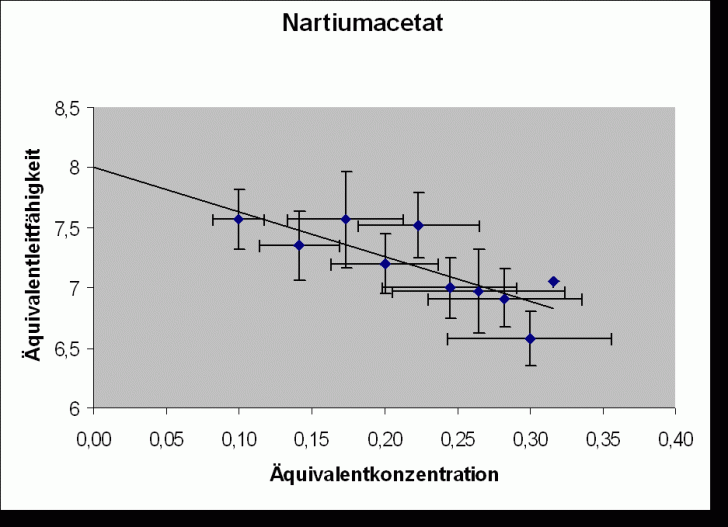
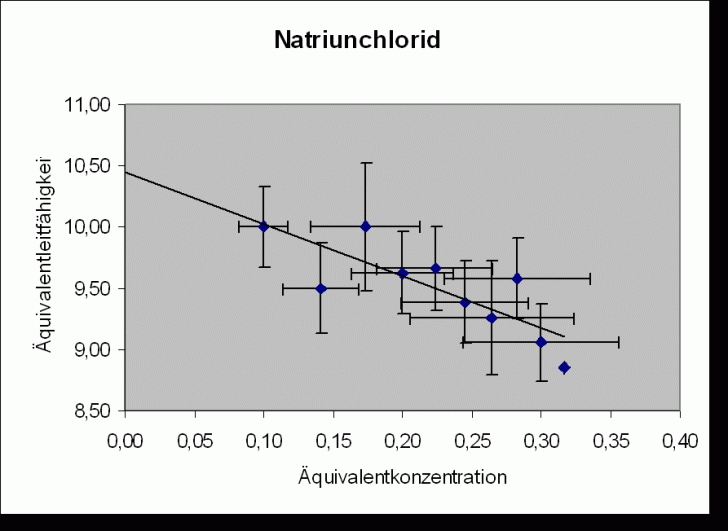
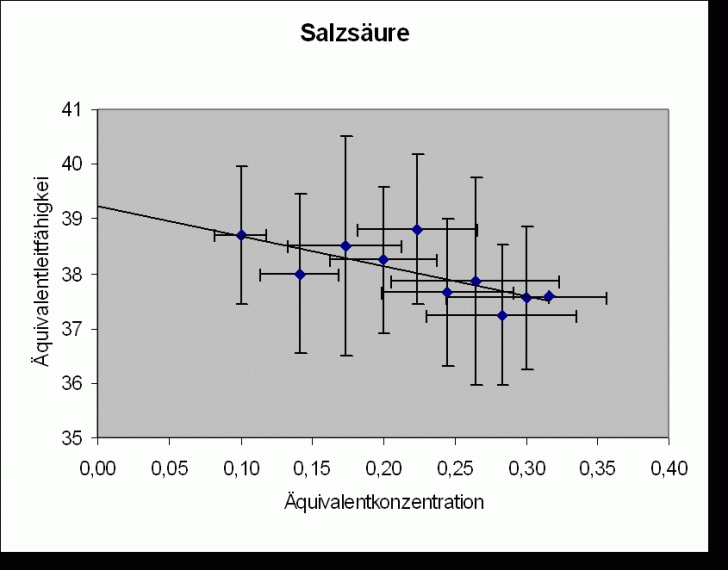
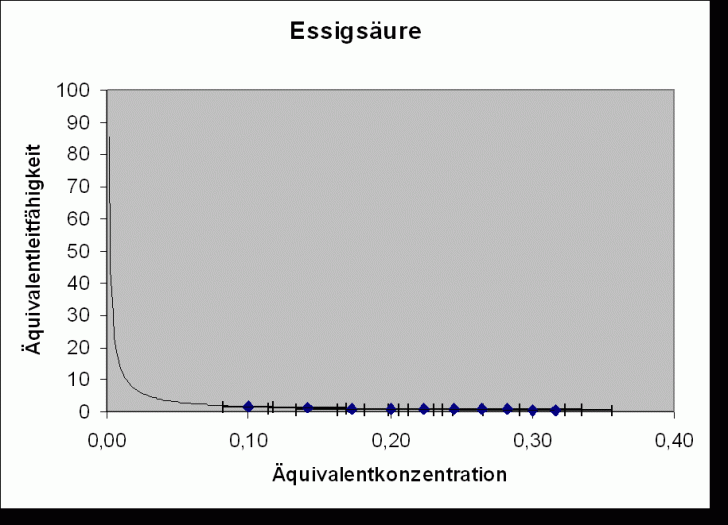
Im Diagramm wird ![]() gegen
gegen
![]() aufgetragen.
Bei allen untersuchten Ionen gilt: z = 1 c = c‘. Daraus folgt für die Regressionsgeraden (nach dem Kohlrauschen
Wurzelgesetz
aufgetragen.
Bei allen untersuchten Ionen gilt: z = 1 c = c‘. Daraus folgt für die Regressionsgeraden (nach dem Kohlrauschen
Wurzelgesetz ![]() ):
):
Steigung 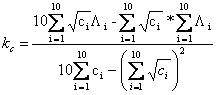

Unsicherheit der Steigung kc:
Unsicherheit im Achsenabschnitt ![]() :
:
Korrelationsfaktor

Regressionsgerade:
![]()
|
Aquivalentleitfähigkeit |
Grenzleitfähigkeit |
Korrelationsfaktor r |
|
|
Natriumchlorid |
(10,4 |
104 | |
|
Natriumacetat |
(8,0 |
80 | |
|
Salzsäure |
(39,2 |
392 |
![]() = (80
= (80 ![]() 3)
3) ![]() + (392
+ (392 ![]() 4)
4)![]() - (104
- (104 ![]() 3)
3) ![]() = (384
= (384 ![]() 10)
10) ![]()
![]()
Dissoziationsgrad ![]()
|
Essigsäure |
|||
|
c in |
|
|
Kc in |
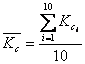 = 17.72 *
= 17.72 *![]()
Mit der Annahme, daß durch die Mittelwertbildung die Unsicherheiten der Einzelwerte im Vergleich zur Streuung der Mittelwerte bedeutungslos werden, gilt:
![]()
![]() =
(17.72
=
(17.72 ![]() 1,38)
*
1,38)
*![]()
Wasserhärte
k =F *c * (v+ + v-)
![]() = 5,06 *
= 5,06 * ![]()
Da 1 * ![]() 2,804° dH entsprechen, hat das Leitungswasser
14,2° dH.
2,804° dH entsprechen, hat das Leitungswasser
14,2° dH.
|
Politica de confidentialitate | Termeni si conditii de utilizare |

Vizualizari: 5906
Importanta: ![]()
Termeni si conditii de utilizare | Contact
© SCRIGROUP 2025 . All rights reserved