| CATEGORII DOCUMENTE |
| Bulgara | Ceha slovaca | Croata | Engleza | Estona | Finlandeza | Franceza |
| Germana | Italiana | Letona | Lituaniana | Maghiara | Olandeza | Poloneza |
| Sarba | Slovena | Spaniola | Suedeza | Turca | Ucraineana |
DOCUMENTE SIMILARE |
|
Come dice il termine sono quei composti costituiti esclusivamente da H e C. Vengono classificati generalmente in cinque famiglie fondamentali:
TABELLA (3)
|
FORMULA GENERALE |
FAMIGLIA A CUI APPARTENGONO |
DESINENZA |
IBRIDIZZAZIONE |
|
CnH2n+2 |
ALCANI (IDROCARBURI SATURI O PARAFFINE) |
- ANO - |
sp3 |
|
CnH2n |
ALCHENI (IDROCARBURI INSATURI O OLEFINE) |
- ENE - |
sp3 |
|
CnH2n-2 |
ALCHINI IDROCARBURI INSATURI O serie dell’acetilene) |
- INO - |
sp |
|
CnH2n |
CICLO ALCANI (CICLOPARAFFINE O NAFTENI) |
- ANO - |
sp3 |
|
(4n+2) |
ARENI O IDROCARBURI AROMATICI |
- ENE - |
sp2 |
Il problema della nomenclatura degli idrocarburi e di tutti gli altri composti organici verrà affrontato tenendo presenti i tre possibili livelli di approccio:
nome sistematico (o ufficiale o I.U.P.A.C.)
nome d’uso comune (o corrente)
nome d’uso comune conservato (proveniente da 2, ma fatto proprio e riconosciuto in 1).
Sono gli idrocarburi che hanno il metano come capostipite, il C con ibridizzazione tetraedrica ed il legame semplice C – C. In tabella è riportato l’avvio della serie degli idrocarburi saturi fino a 5 atomi di C, sviluppando la formula generaleCnH2n+2 ;oltre a quello di struttura si riporta anche la formula razionale che, condensano gli H sul C cui sono legati, costituisce un qualche cosa d’intermedio fra le due.
|
FORMULA BRUTA |
FORMULA RAZIONALE |
FORMULA DI STRUTURA |
NOME |
|
CH4 |
– |
H H – C – H H |
MET – ANO |
|
C2H6 |
CH3 – CH3 |
H H | | H – C – C – H | | H H |
ET – ANO |
|
C3H8 |
CH3 – CH2 – CH3 |
H H H | | | H – C – C – C – H | | | H H H |
PROP-ANO |
|
C4H10 |
CH3 – CH2- CH2 – CH3 |
H H H H | | | | H – C – C – C – C – H | | | | H H H H |
BUT – ANO |
|
C5H12 |
CH3 – (CH2 )3 - CH3 |
H H H H H | | | | | H – C – C – C – C – C - H | | | | | H H H H H |
PENT– ANO |
La radice del nome sistematico, valida non solo per gli alcani, è legata al numero di atomi di C.
NUMERO DI ATOMI DI C |
RADICE DEL NOME IN BASE AL NUMERO DI ATOMI DI C |
|
MET - |
|
|
ET - |
|
|
PROP - |
|
|
BUT - |
|
|
PENT - |
|
|
ES - |
|
|
EPT - |
|
|
OCT - |
|
|
NON - |
|
|
DEC - |
|
|
EICOS- |
Già si è detto che sulla base della rotazione intorno al legame C – C, non ha senso cercare se gli etani possano essere più di uno e la cosa vale anche per i termini superiori. Sotto un’ottica diversa, quella cioè della diversa concatenazione degli atomi di C, ha invece senso indagare su possibili differenze. Si prenda la formula bruta C4H10. Si vede subito che i quattroC possono essere concatenati in modo lineare[18] o in modo ramificato[19] e le due strutture rappresentano due molecole realmente diverse, fisicamente e chimicamente distinguibili. Quale delle due rappresenta il butano? Entrambe.
H H H H H H H 1 2 3
| | | | | | | CH3 – CH – CH3
H – C – C – C – C – H H – C – C – C - H |
| | | | | | | CH3
H H H H H H – C – H H
|
H
[18] [19] [19]
Se si prova con il pentano, si riesce a scriverne tre:
C – C – C – C – C C – C – C – C C
| |
C C – C – C
|
C
[20]
Con i C20H42 si riesce a scriverne 366.319! La coppia del butano [18]-[19], la terna del pentano [20]-[21]--[22] e così via, caratterizzate da ugual formula bruta, ma diversa formula di struttura costituiscono un esempio di ISOMERI DI STRUTTURA (detti anche isomeri di catena). Nasce immediatamente il problema della nomenclatura. La nomenclatura corrente indicava come n – butano [18] e come isobutano [19], ma come si fa a inventare 366.319 per l’eicosano? Ecco la necessità di una nomenclatura ufficiale. Per dare il nome ad un alcano la nomenclatura sistematica si basa su alcune regole che possono così essere considerate:
cercare la catena più lunga di atomi di C che fornirà la RADICE del nome;
numerare, preceduti da un numero il più piccolo possibile, i gruppi alchilici (alcani a cui manca un atomo di H), simboleggiati genericamente con –R ;
usare prefissi di molteplicità: MONO, BI, TRI, TETRA
ESEMPI:
CH3 – CH - CH3
| metilpropano [19]
CH3
Il butano [19] ha in realtà una catena di 3 atomi di C ( 3=radice prop - ) al secondo dei quali è attaccato l’alchile - CH3 (cioè metano senza un idrogeno, quindi metile). Dire che il -CH3 è attaccato al C2 è superfluo perché non vi sono alternative. La molecola si chiama ufficialmente METILPROPANO.
CH3 CH3
| |
5CH3 – 4CH – 3CH2 –2C – 1CH2 TRI-METIL – PENT-ANO
CH3 ( 2,2,4 TRIMETILPENTANO)
[23]
Radice PENT- ,prefisso di molteplicità TRI (perché ci sono tre metili); numerazione da destra a sinistra in modo da usare i numeri 2,2,4(questi numeri si riferiscono alla posizione dei gruppi metilici – CH3 ,più piccoli di 2,4,4 numerazione da sinistra).
Quest’esempio è utile per classificare gli atomi di C in :
PRIMARI → legati ad un solo C (sono tali tutti i gruppi – CH3 ) ;
SECONDARI → legati a due C ( - CH2 – del[23] )
TERZIARI → legati a tre C (il numero 4 del[23]) ;
QUATERNARI → legati a quattro C (il numero 2 del[23]) .
|
– C –
| | | | | | | | | |
C1 – C2 – C3 – C4 – C5 – C6 – C7 – C8 – C9 – C10
![]() | | | | | | | | |
| | | | | | | | |
– C – – C – | |
| | – C – – C – – C –
– C – | | |
|
Catena più lunga 10 C = radice del nome DEC – ; i gruppi alchilici vengono citati in ordine alfabetico, l’alchile in 7 ha 3 C, quindi è un propile, chiamato isopropile perché legato con il secondo dei tre C.
Il nome è: 5 ETIL – 7 ISOPROPIL – 3,3 DI METIL DECANO
Si noti che [19] è uno dei due butani, [23] uno dei tanti ottani e [24] uno dei tanti eptani.
Hanno nome di uso comune conservato :
[19] isobutano;
[21] isopentano,
[22] neopentano.
Si esaminino ora le principali proprietà fisiche degli alcani:
da C1 a C4 sono gassosi ed inodori( il metano viene odorizzato con additivi per individuarne le fughe);
da C5 a C8 sono liquidi ed hanno odore di benzina;
![]() da C9 a C sono liquidi inodori
da C9 a C sono liquidi inodori
- oltre C sono solidi
hanno densità massima 0,8 per cui galleggiano sull’acqua(inquinamento da scarico di petroliere;
mai spegnere un incendio di idrocarburi con acqua! );
non sono solubili in acqua.
Si è visto che, tra molecole non polari, si esercitano deboli forze attrattive a livello della superficie, chiamate forze di dispersione o di Van Der Waals. Sarà logico quindi che, al crescere delle dimensioni molecolari, si intensifichi la forza di attrazione reciproca e che lo stato fisico passi gradualmente da gassoso, a liquido, a solido. A pari massa molecolare, diventa determinante la forma della molecola :così ad esempio il pentano [20] bolle a temperatura più alta del neopentano [22], in quanto, pur avendo lo stesso peso molecolare, il pentano ha forma assimilabile ad un cilindro e tra cilindri le forze attrattive superficiali si esplicano meglio che non tra sfere (la cui zona di contatto è ridotta ad un punto).
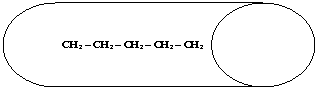
P. EB.=36sC
[20]
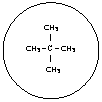
P. EB.=9,5°C
[22]
Sciogliere in acqua un idrocarburo significherebbe spendere energia per vincere l’attrazione idrocarburo – idrocarburo( debole), quella acqua – acqua (forte), per ricavarne quella di formazione dei legami deboli idrocarburo – acqua .
Una molecola fatta di atomi “leggeri”come C e H sarà logicamente leggera, cioè dotata di bassa densità. Si considerino ora gli aspetti chimici (preparativi e reazionali).
I primi sono presto esaminati in quanto di metano e dei suoi fratelli maggiori la natura ne offre in abbondanza nei giacimenti petroliferi. Può avere interesse la sintesi di alcani di struttura particolare.
Gli aspetti reazionali possono essere ricondotti al nome latino PARUM – AFFINI (paraffine), che indica una scarsa reattività. Ci sono tuttavia due reazioni degli alcani sulle quali ci si deve soffermare: CLORURAZIONE e COMBUSTIONE
Se si carica con i due gas, metano e cloro, un recipiente di vetro ricoperto da carta stagnola, non avviene alcuna reazione, nonostante i dati termodinamici [25] la presentino come reazione altamente spontanea e favorita.
![]()
![]() CH3 – H +
Cl – Cl → CH3 – Cl + H – Cl ΔG=
-25Kcal/mol
CH3 – H +
Cl – Cl → CH3 – Cl + H – Cl ΔG=
-25Kcal/mol
K = 1018 ( spostata a destra)
[25] .
Tolta la stagnola, si illumina con luce ultravioletta, assistendo così ad una reazione repentina e quasi esplosiva; la luce ha cioè esercitato il suo effetto catalitico facendo decorrere la reazione attraverso i seguenti stadi .
![]()
![]() alla luce il legame si rompe in parti uguali
si chiama OMOLITICA
alla luce il legame si rompe in parti uguali
si chiama OMOLITICA
![]()
![]()
![]()
![]() Cl • Cl 2Cl
Cl • Cl 2Cl
Le due particelle che sono rimaste sono uguali e sono 2 atomi di Cl definite radicali cloro.
[27]
![]()
![]()
![]() CH4 Cl CH3 + HCl
CH4 Cl CH3 + HCl
![]()
![]() Propagazione
della
Propagazione
della
torna in ciclo catena.
![]() • CH3 + Cl2 CH3Cl + Cl
• CH3 + Cl2 CH3Cl + Cl
[27] e [28] si ripetono finché il radicale cloro e un radicale metile non si uniscono.
In [26] si ha la rottura omolitica del legame Cl – Cl con formazione del radicale Cl • (radicale = atomo o raggruppamento di atomi con un elettrone spaiato ) che in [27] strappa H • al metano formando il radicale metile che in [28] ripristina il radicale Cl • producendo il CLORURO DI METILE; la sequenza di [27] e [28] si ripete a catena .
Alla fine della reazione si trovano:
![]()
![]()
![]()
![]() CH4 CH3Cl CH2Cl2 CH Cl3 CCl4
CH4 CH3Cl CH2Cl2 CH Cl3 CCl4
miscelati tra loro in quanto il Cl • ha la possibilità di strappare H • non solo a CH4 , ma anche a CH3Cl e così via. Gli estremi hanno caratteristiche differenti CH4 ottimo combustibile mentre CCl4 si usava come liquido degli estintori. La reazione costituisce un esempio di reazione di SOSTITUZIONE
La combustione è la reazione per cui un idrocarburo si ossida rapidamente e completamente, ad alta temperatura, ad anidride carbonica ad H2O; è un processo esotermico che, se avviene a pressione costante(“a cielo aperto”), viene valutato attraverso il valore di ΔH . Per la combustione del metano [29] si ha un valore sperimentale in buon accordo con quello calcolabile dai valori tabulati dell’energia di legame.
C – H 99 Kcal/mole
O = O 119 Kcal/mole
C = O 192 Kcal/mole
O – H 111 Kcal/mole
|
Rottura |
4 legami |
C – H |
Kcal/mole |
||
|
Rottura |
2 legami |
O = O |
Kcal/mole |
||
|
Formazione |
2 legami |
C = O |
Kcal/mole |
||
|
Formazione |
4 legami |
O – H |
Kcal/mole |
||
|
Kcal/mole |
![]() CH4
+ 2 O2 CO2
+ 2H2O
CH4
+ 2 O2 CO2
+ 2H2O
ΔH sperimentale = -192 Kcal/mol
Le calorie per demolire i legami CH e la molecola O2 sono assorbite, mentre le altre sono liberate. Questa reazione sviluppa energia.
Come dice il nome, sono alcani a catena chiusa. Ogni carbonio ha quattro legami ed è tetraedrico.
![]()
H H
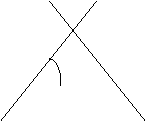
![]() H H
H H
H H
[30] [31]
[32] [33]
Il C ha ibridizzazione sp3, quindi i legami C – C saranno semplici e la desinenza come per gli alcani – ANO. Il loro capostipite ha tre atomi di C ( radice prop -) ed essendo a catena chiusa è chiamato ciclo propano. Sviluppando la formula CnH2n si avrà il ciclo butano nella cui formula semplificata [31] si sottintendono i gruppi CH2 ai vertici, e così via i termini successivi : ciclo pentano [32] , ciclo esano [33]…ecc.
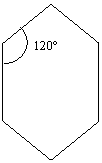
Le proprietà fisiche: sono simili a quelle degli alcani, con piccole differenze a pari n° di atomi di C il cicloalcano fonde e bolle a temperatura più alta dell’alcano. Merita soffermarsi sulla geometria e sulle proprietà chimiche: dei cicloalcani (o cicloparaffine o nafteni). Siccome gli orbitali ibridi sp3 del C formano angoli di 109°28´ , male si adatteranno ad un triangolo regolare, la loro sovrapposizione sarà scarsa, la tensione angolare elevata (colonna B) ed il legame C – C instabile. Nel ciclobutano le cose migliorano: “bruciando” un gruppo CH2 in un alcano si ottengono sperimentalmente 157 Kcal/mole (valore medio), mentre ogni gruppo CH2 del ciclobutano sperimentalmente ne fornisce 7 di più(colonna D) indicando un maggior contenuto energetico( minore stabilità) anche se le cose sono migliorate rispetto al ciclo propano( che ha, per ogni gruppo CH2 ,un sovrappiù di instabilità di 10Kcal/mole). Nel ciclopentano dove l’angolo del pentagono (108°) meglio si concilia con quello del tetraedro, si trova ancora una differenza di 2 Kcal/mole che ,sorprendentemente, si annulla nel cicloesano nel quale la tensione negativa avrebbe lasciato supporre un’instabilità per ragioni di angolo geometrico superiore a 109°28´.
TABELLA (3).
|
A |
B |
C |
D |
|
ATOMI DI C |
109° - ANGOLO |
H OPERING / CH2 |
(-ΔH OPERING/ CH2)-157 |
109° - angolo → differenza tra angolo tetraedrico – angolo della figura che si creerebbe .
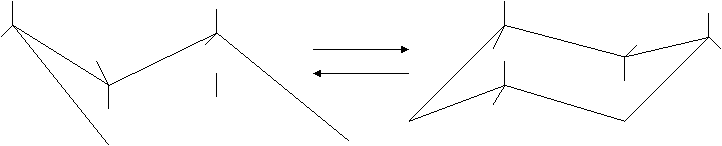
La colonna D prosegue per i termini 7, 8, 9, e più atomi di C, con valore 0, nonostante l’angolo geometrico vada crescendo. La cosa si spiega perfettamente in base ll’osservazione sperimentale dal cicloesano in su, gli anelli non sono più polari e gli atomi di C assumono una conformazione con angoli C – C – C esattamente di 109°28´, tale da garantire la massima stabilità. Le due conformazioni che rappresentano il cicloesano sono le seguenti:

![]()

![]()
![]()
![]()
![]()
![]()
![]()
![]()
Hanno la stessa energia e sono in continua rapidissima interconversione, per cui risultano indistinguibili. I dodici atomi di H occupano alternativamente posizioni assiali (verticali) ed equatoriali: nel passare da una all’altra ogni H assiale diventa equatoriale ( e viceversa). Quando al posto degli H ci siano atomi o gruppi atomici particolarmente ingombranti l’interconversione può essere impedita e le due conformazioni diventano distinguibili, fisicamente e chimicamente diverse, cioè due isomeri chiamati ISOMERI CONFORMAZIONALI
LE PROPRIETA’ CHIMICHE: dei cicloalcani sono, nella maggior parte, paragonabili a quelle degli alcani
Alcheni
Sono gli idrocarburi di formula generale CnH2n caratterizzati dalla presenza del doppio legame C = C il capostipite è l’etilene [39] (nome sistematico et – ene ), i successivi sono i seguenti:
CH2 = CH – CH3 PROPENE
![]() CH2
= CH – CH2 – CH3 1 – BUTENE
CH2
= CH – CH2 – CH3 1 – BUTENE
Isomeri strutturali
CH3 – CH = CH – CH3 2 – BUTENE
Come si vede i buteni sono due, tra loro isomeri strutturali. Questa volta la diversità di struttura ,
fermo restando il tipo di catena lineare a quattro atomi di C , è dovuta alla posizione del doppio legame fra C1 e C2
nell’ 1 – butene e fra C2 e C3 nel 2 – butene. È facile immaginare l’ampia gamma di isomeri di questo tipo formata dagli alcheni con molti atomi di C a catena sia lineare che ramificata.
LA NOMENCLATURA sistematica usa la desinenza – ene e la radice della catena più lunga contenente il doppio legame, numerata in modo da attribuire al medesimo il numero più piccolo possibile
ESEMPI:
CH2 = CH – CH2 – CH3 1 – butene (per indicare che il doppio legame lega
C1 con C2 basta il numero 1 ).
CH3 – CH = CH – CH3 2 – butene (per indicare che il doppio legame lega
C2 con C3 basta il numero 1 ).
| | | | | |
– C6 – C5 – C4 = C3 – C2 – C1 – 2 – metil – 3 esene
| | | la numerazione invertita avrebbe conservato il n°3
– C – al doppio legame, ma attribuito il n°5 al metile, in
| contrasto con la regola dei numeri più piccoli possibili.
C1 – C2 – C3 = C4 8 – metil – 3 nonene ;
| questa volta il doppio legame è prioritario rispetto
C5 al metile, nel determinare la determinazione che gli
| consenta il valore più basso.
C6 – C7 – C8 – C9
|
C
Si osservi ora più dettagliatamente il 2 – butene.
H H H CH3
![]()
![]()
![]()
![]()
![]()
![]() C = C C = C
C = C C = C
![]()
![]()
CH3 CH3 CH3 H
[37] [38]
CIS TRANS
Le due formule rappresentano i due isomeri geometrici cis e trans ,costituendo un esempio specifico del caso generale già rappresentato dalle configurazioni [14] e [15]. Negli alcheni superiori potrà quindi capitare di far corrispondere, ad una formula bruta ,strutture diverse per il tipo di catena per la posizione del doppio legame e per l’assetto spaziale dei gruppi rispetto ad esso (cis, trans). Mentre le PROPRIETA’ FISICHE degli alcheni non si discostano molto da quelle degli alcani e dei cicloalcani, diventa particolarmente interessante esaminare sia i metodi di preparazione che la reattività dei composti contenenti il legame C = C. Per introdurre il doppio legame si ricorre ad una reazione di eliminazione di cui si riportano tre esempi fondamentali:
![]()
![]()
![]()
![]()
![]()
H H
![]()
![]()
![]()
![]()
![]()
| | - H2
![]() H – C – C – H
H – C – C – H
| |
H H
![]()
![]()
![]()
![]()
![]()
![]()
![]() H OH H H
H OH H H
![]()
![]()
![]()
![]()
![]()
| | - H2O
![]()
![]()
![]()
![]() H – C – C – H C = C
H – C – C – H C = C
| |
H H
![]()
![]()
![]()
![]()
![]() H H
H H
H Cl
![]()
![]()
![]()
![]()
![]()
| | - H2Cl
![]() H – C – C – H
H – C – C – H
| |
H H
In 1 si deidrogena un alcano (usando catalizzatori eterogenei come Ni e Pt)
In 2 si disidrata un alcol (usando un acido forte come il solforico)
In 3 si deidroalogena un alogenoalcano (usando una base forte come l’idrossido di potassio).
Dal punto di vista reazionale , il doppio legame costituisce un facile punto di attacco, contrariamente a quanto lascerebbe supporre. Gli elettroni del legame π si respingono reciprocamente in quanto costretti a vivere nell’angusto interspazio tra i nuclei dei due C, per cui reattivi elettrofili trovano un substrato ideale nel quale dare REAZIONI DI ADDIZIONE che si risolvano nella trasformazione del composto insaturo in composto saturo.
Le reazioni viste, fatte in senso inverso, costituiscono l’esempio di altrettante addizioni del doppio legame: di H( etilene → etano), di H2O (etilene → alcool etilico), di acido cloridrico (etilene → cloroetano). A queste tre se ne aggiungono altre qui riportate (si usa, nell’esempio, l’etilene, ma le reazioni valgono, fatte salve alcune complicazioni, per gli alcheni in generale) FIGURA
Quando nella reazione [39] inversa si addiziona HCl all’etilene, se ne ricava cloroetano. Se si fa la stessa cosa sul propene [34] ci si trova teoricamente di fronte a due alternative:
Se H si lega al C1 e Cl al C2 si ottiene 2 – cloropropano [40] ;
Se H si lega al C2 e Cl al C1 si ottiene 1 – cloropropano [41] .
H Cl H
| | |
H – C – C – C – H
| | |
H H H
2 – CLOROPROPANO
Cl H H
| | |
H – C1 – C2 – C3 – H
| | |
H H H
CLOROPROPANO
Quale dei due isomeri strutturali si ottiene sperimentalmente? La risposta è stata data oltre un secolo fa da Markovnikov nella sua regola : nell’addizione di un acido ad un alchene, l’H si lega a quell’atomo di carbonio del doppio legame che porta il maggior numero di atomi di H .In questo caso si formerà per tanto l’isomero [40] .
CH2 = CH – CH3
![]()
H si attacca qui perché ci sono più H, se il reattivo è di acido cloridrico avrò questo prodotto
![]()
CH3 – ClCH – CH3
FIGURA
Br H
| |
![]() Br – Br H – C – C – H 1,2 di bromoetano
Br – Br H – C – C – H 1,2 di bromoetano

![]() bromo | | [42]
bromo | | [42]
H Br
H O – SO3H
![]() | |
| |

![]() H – O – SO3H H – C – C
–H solfato acido
di etile
H – O – SO3H H – C – C
–H solfato acido
di etile
Acido solforico | | [43]
H H
OH Cl
| |
H – O – Cl H – C – C – H cloridrica etilenica
![]() | | [44]
| | [44]
Acido ipocloridrico H H
H H
![]()
![]()

![]()
![]() C = C
C = C
H H
O3 H – C = O O = C – H formaldeide
![]() ozono | | [45]
ozono | | [45]
H H
OH OH
| |
KMnO4 H – C – C – H glicole etilenico
![]() | | [46]
| | [46]
permanganato di potassio H H
(reazione di ossidrilazione)
![]()
![]()
H H
| |
![]()
![]() C – C
C – C
| | H H
![]() H H n | |
H H n | |
![]()
![]() etilene (poliaddizione) C – C polietilene
etilene (poliaddizione) C – C polietilene
| | [47]
H H
n + 1
Le reazioni che portano ai composti 1,2 dibromoetano [42], formaldeide [45] e glicole etilenico [46] (vedi figura4) hanno anche valore analitico e consentono di rivelare la presenza del doppio legame :le soluzioni di bromo e permanganato sono colorate in rosso e in viola, e in presenza di doppi legami con cui reagiscono si decolorano; i prodotti della ozonizzazione consentono di risalire alla struttura dell’alchene da cui derivano. In [47] è riportato il caso limite dell’addizione di un alchene su se stesso (etilene + etilene, dimerizzazione), operazione che può essere ripetuta fino alla formazione di un vero e proprio polimero (poliaddizione, polimerizzazione).
In un alchene si verificano le reazioni ora esposte, a livello del doppio legame ma, nella rimanente parte della molecola (dove ci sono C di tipo sp3), si avranno le reazioni più caratteristiche degli alcani.
H
|
 CH2 = CH – C – Br [48]
CH2 = CH – C – Br [48]
|
+ Br – Br H
H
|
 CH2 = CH – C – H
CH2 = CH – C – H
| Br Br H
H | | |
Br – Br H – C – C – C – H [49]
| | |
H H H
Così, ad esempio, trattando il propene con bromo in presenza di luce che consente la formazione di radicali Br• si avrà una sostituzione con formazione di “bromuro di allile” [48] (allile, [51]), mentre, impiegando bromo in condizioni che favoriscano la formazione di ioni, si forma 1,2 di bromo propano [49] , cioè il prodotto di addizione (alcani → sostituzione,
alcheni → addizione). La formula del propene offre lo spunto per citare due alchenili ( alchen–, perché c’è il doppio legame, -ile perché manca un H) molto importanti di cui si è conservato il nome d’uso comune.
![]()
![]()
![]() H H
H H
C = C FORMULA DI STRUTTURA
![]()
![]()
VINILE
H
CH2 = CH – FORMULA BRUTA
![]()
![]()
![]() H H
H H
C = C FORMULA DI STRUTTURA
![]()
![]() H
H
|
H C –
| ALLILE
H
CH2 = CH – CH2 – FORMULA BRUTA
Come dice il termine, sono quegli alcheni nelle cui molecole si trovano più doppi legami. Rientrano ( a parte la formula generale) negli alcheni. Più doppi legami possono reciprocamente trovare in tre diverse posizioni. Isolati [52] ed in tale caso ci si troverà di fronte alle proprietà dei mono–eni semplicemente raddoppiate , triplicate, ecc…in modo puramente quantitativo.
Consecutivi come in [53] , capostipite dei cumuleni, chiamato allene e caratterizzato da una rigida geometria che impone a due H di stare in un piano e agli altri due di stare in un altro ortogonale al primo.
Alternati (o coniugati) come in [54] capostipite dei polieni coniugati, chiamato 1,3–butadiene, al quale è praticamente dedicato il paragrafo.
C = C – C – C – C = C – C
H H
![]()
![]()
![]()
![]() C = C = C
C = C = C
H H
H H
![]()
![]()
![]() C = C H
C = C H
![]()
![]()
H C = C
![]()
![]()
H H
Se si tiene presente che il doppio legame risulta dalla sovrapposizione degli orbitali 2pz degli atomi di C sp2, quando si scrive una catena di quattro atomi evidenziando l’orbitale 2pz [55] ,viene spontaneo chiedersi se sia del tutto verosimile la scrittura [54] nella quale si sono localizzati i doppi legami immaginando una rigida sovrapposizione 2pz di tipo C1 + C2 e C3 + C4 ,trascurando una sovrapposizione C2 + C3 .
I dati sperimentali aiutano a rispondere: i legami C1 – C2 e C3 – C4 hanno una lunghezza di 1,37Å (leggermente superiore a quella di un doppio legame ordinario), il legame C2 – C3 di 1,47Å( leggermente inferiore a quella di un legame semplice ordinario) indicando che non è giusto localizzare i doppi legami. Nella pratica è accettata la rappresentazione [54], a legami localizzati, che rispetta formalmente la tetravalenza del C, tuttavia è bene tener presente che si tratta di una scrittura di comodo. Un altro dato sperimentale a conferma di quanto detto: addizionando bromo al butadiene si ottiene una miscela di due isomeri strutturali [56] e [57] .



![]()
![]()
![]() 1C 2C 3C 4C 2pz
1C 2C 3C 4C 2pz
[55]
Br Br
| |
H – 1C – 2C – 3CH = 4CH2
| |
H H
Br Br
| |
H – 1C – 2CH=3CH – 4C – H
| |
H H
In [56] si è avuta la classica addizione su uno dei due doppi legami chiamata addizione 1,2; in [57] si è avuta un’addizione 1,4 con “slittamento” del doppio legame in 2,3; l’addizione 1,4 sul butadiene presenta due esempi di notevole interesse la polimerizzazione [58] sulla quale si ritornerà a proposito della gomma, e la cicloaddizione, nota come reazione di “Diels e Alder” [59]che porta alla formazione dei cicloalcheni.
![]()
![]()
![]() CH2 = CH – CH = CH2 + CH2 = CH – CH =
CH2 CH2
– CH = CH – CH2 – CH2 – CH = CH – CH2
CH2 = CH – CH = CH2 + CH2 = CH – CH =
CH2 CH2
– CH = CH – CH2 – CH2 – CH = CH – CH2
[58]
![]()
![]() CH2 CH2
CH2 CH2
![]()
![]()
![]()
![]() CH CH2 CH CH2
CH CH2 CH CH2
![]() + ||
+ ||
![]()
![]() CH CH2 CH CH2
CH CH2 CH CH2
![]()
![]()
CH2 CH2
CICLOESENE
[59]
Alchini
Sono idrocarburi contenenti uno o più tripli legami C ≡ C di formula generale: Cn H2n-2 . Capostipite è l’acetilene H – C ≡ C – H (nome sistematico, non usato, etino), cui seguono propino, butino, pentino, ecc…
Sotto numerosi profili gli alchini si ricollegano direttamente agli alcheni, salvo piccole modifiche:
Nella nomenclatura : si seguono le stesse regole degli alcheni sostituendo – ene con – ino ;
Come gli alcheni presentano isomeria di catena e di posizione del triplo legame ;
Si possono preparare con le reazioni viste con gli alcheni[39] che reagiscono secondo le reazioni inverse (seguendo la regola di Markovnicov), raddoppiando ovviamente le quantità e passando attraverso lo stadio di alchene.
Cl Cl H Cl
![]()
![]()
![]()
![]() | | -HCl - HCl
| | -HCl - HCl
![]()
![]() H – C – C – H C
= C H – C ≡ C – H
H – C – C – H C
= C H – C ≡ C – H
![]()
![]() | | +HCl + HCl
| | +HCl + HCl
H H H H
[60] [61] [18]
Hanno proprietà fisiche simili ad alcheni ed alcani.
Alcune caratteristiche sono invece specifiche dei composti a triplo legame. A livello del triplo legame non si verifica isomeria cis e trans, in quanto tale legame ha simmetria cilindrica e viene a mancare il piano al di qua e al di là del quale collocare i vari gruppi. Occorre tenere presente il caso particolare dell’addizione dell’ H2O : dopo l’addizione della prima molecola d’acqua all’acetilene, si forma l’alcol vinilico [62] il quale è instabile e, anziché addizionare una seconda molecola d’ H2O,si stabilizza facendo migrare un H dall’ ossidrile al C2 con formazione di aldeide acetica [63] che è il prodotto praticamente attendibile dalla reazione.
![]() H OH H O
H OH H O
![]()
![]()
![]()
![]()
+ H2O
![]()
![]()
![]()
![]() H – C ≡ C – H 2C
= 1C H – 2C – 1C
H – C ≡ C – H 2C
= 1C H – 2C – 1C
![]()
![]()
![]()
H H H H
[18] [62] [63]
I composti [62] e [63] sono isomeri strutturali collegati tra loro da una relazione di equilibrio: sono denominati TAUTOMERI
Si noti che butano[18] e metilpropano[19], classici isomeri strutturali, non sono affatto legati da un equilibrio chimico e quindi il passaggio dall’uno all’altro è cosa molto complessa da realizzare. Trattando gli alchini con certi metalli si isolano veri e propri sali, come l’acetiluro di sodio che è il sale di sodio dell’”acido” acetilene. Gli alchini sono dunque dei composti di natura acida (occorre che ci sia almeno un H legato al C del triplo legame), a differenza dagli altri idrocarburi. Si tratterà ovviamente di acidi deboli, più deboli dell’ H2O, che cede un protone ai loro sali idrolizzandoli [64] .
![]()
![]() H – C ≡ C-Na+ + H2O H – C ≡ C – H + Na+
+ OH-
H – C ≡ C-Na+ + H2O H – C ≡ C – H + Na+
+ OH-
Esempio classico è la preparazione dell’acetilene dal carburo di calcio CaC2 [65], che costituisce la normale reazione di idrolisi del carburo (o acetiluro) di calcio. Con metalli quali mercurio, argento, rame, si formano acetiluri insolubili che, allo stato secco, esplodono con facilità.
C- C – H
![]()
![]() ||| Ca++ + 2 H2O + Ca++ +2 OH-
||| Ca++ + 2 H2O + Ca++ +2 OH-
![]() C- C – H
C- C – H
Ca(OH)2
|
Politica de confidentialitate | Termeni si conditii de utilizare |

Vizualizari: 2221
Importanta: ![]()
Termeni si conditii de utilizare | Contact
© SCRIGROUP 2025 . All rights reserved