| CATEGORII DOCUMENTE |
| Alimentatie nutritie | Asistenta sociala | Cosmetica frumusete | Logopedie | Retete culinare | Sport |
Periodontitele, factor de risc al afectiunilor cardiovasculare acute
Rezultatele numeroaselor cercetari medicale au permis recunoasterea inflamatiei ca factor patogenic al bolii aterosclerotice, deschizand posibilitati noi de cercetare in acest domeniu. Relativ recent, studii izolate dar semnificative statistic demnaleaza rolul central al inflamatiei ininitierea si evolutia aterosclerozei. Studiile histologice si biochimice au adus argumente in favoarea rolului inflamatiei (localizata la nivelul placii de aterom sau la distanta de aceasta) de factor favorizant in aparitia accidentelor vasculare coronariene acute si/sau cerebrale.
Pornind de la posibila implicare a periodontitelor in favorizarea instalarii accidentelor acute vasculare prezentul articol urmareste sa evidentieze complexitatea patogenica a interrelatiei artera-spectru lipidic sanguin-inflamatie. Justificarea abordarii unui astfel de subiect consta in necesitatea efectuarii unor studii mai aprofundate, efort motivat de perspectivele terapeutice care se contureaza pentru incetinirea procesului de ateroscleroza.
A. Ateroscleroza principala cauza a cresterii morbiditatii si mortalitatii prin boli ale aparatului cardio-vascular.
Studiul
principalelor cauze de mortalitate din
|
|
|
Fig.1 Rata mortalitatii brute din |
Intre bolile cardio-vasculare, generatoare de deces, accidentele acute coronariene si cerebrale se situeaza pe primul loc. In marea lor majoritate decesele de acest tip sunt datorate obstructiei acute sau ruperii vasului la nivelul unei leziuni parientale vasculare de natura aterosclerotica.
Definitia data acestei boli de catre expertii OMS in urma cu aproape 50 de ani, desi enumera numai elemente descriptive morfologice, faciliteaza insa intelegerea patogeniei bolii. Aceasta deoarece ateroscleroza este considerata ca o combinatie variabila de modificari ale intimei arterelor, constand in acumulari focale de lipide, glucide complexe, tesut fibros, calciu si sange (substante si elemente figurate) asociata cu modificari ale mediei. Definitia sintetizeaza astfel rolul a cel putin doi din factorii implicati in aterogeneza: factorul parietal vascular reprezentat prin stratul endotelial si media arterelor si cel circulant-umoral, identificat prin elementele din compozitia plasmei (lipoproteine, tromboxani, calciu, prostaglandine) dar si prin plachetele circulante.
Existenta aterosclerozei
extinse evidentiata prin explorare paraclinica, dar cu nivele
normale ale fractiunilor lipidice sanguine a impus recunoasterea
implicarii mecanismului inflamator in patogenia acestei boli degenerative.
Astfel potrivit conceptelor actuale privind fiziopatologia aterosclerozei,
aceasta este o boala cu mecanism patogenic complex si multifactorial
determinat, care include si o componenta inflamatorie. Co-participarea
inflamatiei implica mecanisme imune si eliberarea de factori
activi circulanti, enzimatici sau umorali, care au rol atat in
initierea procesului lezional regional, cat si in progresia
aterosclerozei. Indiferent de stadiul evolutiv al aterosclerozei studiile
histochimice au evidentiat prezenta
Procesul aterosclerotic evolueaza cu participarea celulelor endoteliale si a celor inflamatorii de tip monocitar si macrofagic (migrate sau existente local). In dinamica, prin transformarea macrofagelor in celule spumoase concomitent cu un proces de proliferare a celulelor musculare netede arteriolare asociat cu unul de migrare subintimala a acestora se constituie structura de mozaic caracteristica placii de aterom. Procesul inflamator care are loc in etapa de debut a aterosclerozei apare ca raspuns la o agresiune exercitata probabil de lipoproteinele cu densitate joasa oxidate (LDL- ox.) si/sau un agent infectios.
Deoarece inflamatia reprezinta un ansamblu de reactii care apar ca raspuns la agresiunea unor factori interni sau externi, lezarea initiala a intimei arterelor in ateroscleroza este cu siguranta rezultatul unei agresiuni de natura infectioasa sau chimica, exercitata local probabil de catre LDL- ox. Agentul cauzal chimic cel mai frecvent incriminat este reprezentat de catre fractiunile LDL, care se oxideaza mai usor (conditie patogenica primordiala obligatorie pentru declansarea procesului inflamator atherosclerotic). Susceptibilitatea la oxidare a diverselor subtipuri de LDL este determinata de concentratia in oxidanti si de continutul in colesterol liber (fig. 2).
|
|
|
|
a. dupa Fredrickson D.S. si colab. |
b. dupa Skipski V.P. |
|
Fig. 2 Compozitia chimica a LDL circulante |
|
Pentru LDL, din punct de vedere biochimic se descrie o heterogenitate structurala, generata in special de compozitia variata a apoproteinelor (apo-LDL). In mentinerea integritatii structurale si functionale a LDL si a interactiunii dintre particulele LDL un rol important revine apo-B100 din structura lor. Aceasta apolipoproteina sub aspectul concentratiei creste cu varsta in cazul femeilor, fenomen nesemnalat la barbati. Din totalul plasmatic al apoproteinei B la indivizii normolipemici 90% este reprezentata de apo-B din compozitia LDL (72 mg%).
In organismul uman, LDL si HDL sunt principalii vectori ai colesterolului. (tabel. 1)
|
Clasa de lipoproteine |
Tipul de component continut, in % din total |
|||
|
Lipide |
proteine |
|||
|
colesterol |
fosfolipide |
trigliceride |
||
|
Chilomicroni |
5 |
4 |
90 |
1 |
|
VLDL |
13 |
12 |
65 |
10 |
|
LDL |
43 |
22 |
10 |
25 |
|
HDL |
18 |
30 |
2 |
50 |
Tabel. 1 Compozitia procentuala in fractiuni lipidice a claselor de lipoproteine.
Clasa HDL este antiaterogena, in timp ce clasa LDL este puternic aterogena mai ales in forma subtipului LDL dense. Aceasta deoarece comparativ cu clasa LDL mari, LDL dense au un continut mult mai mic in colesterol liber si antioxidanti si sunt mai bogate in acizi grasi polinesaturati si hidroperoxizi. LDL provine din doua surse: sinteza hepatica si la nivel de celula endoteliala arteriala. Efectul antiaterogenic al clasei HDL este rezultatul actiunii directe a acestei clase de a neutraliza lipopolizaharidele serice produse de bacterii si de a proteja LDL de oxidare prin paraoxonaza (enzima cu actiune antioxidanta) pe care o contin.
Oxidarea LDL induce transformari structurale ale acestei clase cu:
a) formarea de aldehide care interactioneaza cu resturile de lizina din apo-B100, formand baze Schiff;
b) pierderea moleculelor de antioxidanti (carotenoizi, γ-tocoferol, ubiquinol 10);
c) diminuarea continutului de acizi grasi polinesaturati;
d) scindarea moleculei apo-B100 cu perturbarea functionala a LDL.
Efectul antiaterogen al HDL este datorat si transportului invers al colesterolului de la tesuturi la ficat.
B. Implicarea in aterogeneza a fagocitozei, proces principal al reactiei inflamatorii
Rolul factorului inflamator, indiferent de localizare in procesul de ateroscleroza este un concept nou care poate fi definit si ca factor de risc de natura endogena, care perturba metabolismul celular local si deregleaza mecanismele de control ale acestuia. Actiunea factorului inflamator in procesul dinamic de instalare a aterosclerozei poate fi invocata la cel putin doua nivele patogenice:
a) La nivel local, endarterial, acesta intervine ca factor pro-aterogen initiind procesul aterogenetic, dar si ca mecanism care modifica stabilitatea placii de aterom in ateroscleroza deja constituita. In aceasta ultima situatie clinica, rezultatul va fi instalarea unui sindrom acut, clinic manifestat prin ischemie tisulara (coronariana, mezenterica, cerebrala, periferica, etc.)
b) Factorul inflamator desi este situat la distanta si este relativ minor, fara o legatura patogenica evidenta cu procesul de ateroscleroza care se desfasoara in organism, coexista frecvent si influenteaza defavorabil evolutia bolii degenerative arteriale. Mecanismul fiziopatologic incriminat in aceste situatii este reducerea capacitatii antioxidante a lichidului extracelular dar si alterarea mecanismului de clearance macrofagic si hepatocitar, cu aparitia in circulatie a markerilor inflamatiei, dintre care unii au actiune procoagulanta (cazul fibrinogenului plasmatic).
In sprijinul acestei ipoteze vin si rezultatele a numeroase studii care au demonstrat ca afectiuni inflamatorii minore, dar frecvente ca raspandire, precum periodontitele (in special in forma lor clinic-agresiva), pot influenta nefavorabil alte maladii sistemice gen bolile cardiovasculare, microangiopatia diabetica, etc. In aceste cazuri, factorul inflamator situat la distanta contribuie patogenic la accelerarea evolutiei obstructive a leziunii ateromatoase prin:
accentuarea dislipoproteinemiei si favorizarea depunerilor endoteliale care vor constitui placa de aterom.
instalarea dezechilibrului fluido-coagulant din circulatie.
Un argument in sprijinul celor afirmate este evidentierea histochimica a prezentei anticorpilor anti-Porphyromonas gingivalis (microb ubiquitar raspandit in cavitatea bucala) in placa de aterom coronariana.
Astazi este unanim admis ca mecanismul principal de aparare nespecifica in cursul reactiei inflamatorii este fagocitoza, care se realizeaza cu participarea celulelor sistemului fagocitar mononuclear fix si mobil. Procesul care are ca obiectiv principal bacterioliza si ca proces secundar refacerea mecanismelor de clearence fluido-coagulant, implica importante modificari metabolice ale glucidelor, fosfolipidelor si trigliceridelor. Biochimic acesta este localizat in trei sisteme:
a. suntul pentozofosfatilor, a carui activitate creste intens in timpul fagocitozei. Fagocitoza este caracterizata printr-un puseu respirator materializat printr-o crestere spectaculoasa a consumului oxigenului molecular si a glucozei metabolizata pe calea pentozofosfatilor. Rezultatul activarii acestui ciclu este productia crescuta de NADPH
b. sistemul NADPH-oxidazei, enzima cheie a fagocitozei in neutrofilele activate. Activarea ei are loc in urma interactiunii diferitilor liganzi (fragmentul C5a al complementului, peptide chemotactice, etc.) cu receptorii de pe membrana plasmatica. In urma rectiei catalizate de aceasta enzima rezulta anion superoxid (O2-). Anionul superoxid format se transforma in H2O2 spontan sau prin reactia catalizata de superoxid dismutaza. H2O2 fie parcurge reactia Fenton si formeaza un anion si un radical hidroxil sau reactioneaza cu Cl- in reactia catalizata de mieloperoxidaza si formeaza hipoclorit (OCl-). In ambele cazuri se formeaza compusi cu actiune bactericida.
c. sistemul bactericid al mieloperoxidazei, enzima localizata in granulele azurofile ale leucocitelor polimorfonucleare, care genereaza compusi cu actiune bactericida. (fig.nr 3)
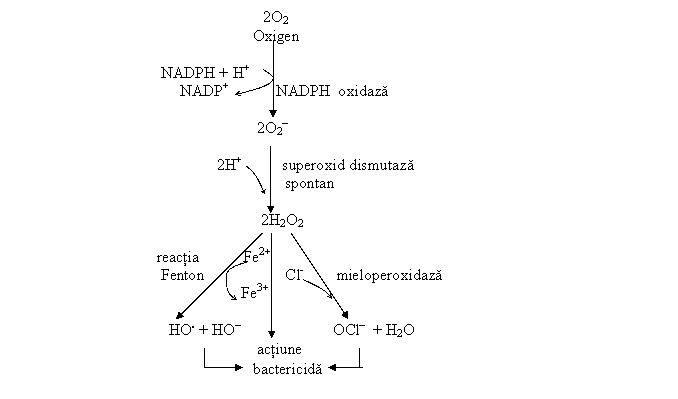
Fig. 3: Caile de generare ale ROS
Potrivit literaturii medicale studiate de noi, periodontitele sunt afectiunile inflamatorii cele mai frecvent studiate sub raportul consecintelor pe care le induc asupra evolutiei aterosclerozei.
Realizarea "digestiei microbiene" in cursul procesului de fagocitoza implica producerea locala de radicali liberi ai oxigenului (ROS), "specii chimice"care contin un electron necuplat pe ultimul strat. Cei mai importanti ROS sunt anionul superoxidul (O2-), peroxidul de hidrogen (H2O2) si ionul hidroxil (HO-).
Actiunea bactericida a ROS se exercita prin oxidarea lipidelor si proteinelor bacteriilor, si prin denaturarea ADN-ului bacterian. ROS reprezinta un stres oxidativ si pentru celulele implicate in fagocitoza, care pot fi afectate si distruse. Astfel, in mod normal, un neutrofil care a fagocitat 5-20 bacterii, este distrus de macrofage in timp ce macrofagele pot sa isi elimine compusii de degradare si sa isi continuie activitatea un timp mai indelungat, si abia apoi sa fie distruse . In decursul evolutiei filogenetice, organismul uman si-a dezvoltat sisteme autioxidante care sa-l protejeze, precum glutationul sau unele vitamine. Din punct de vedere fiziopatologic inflamatia indiferent de etiologie (tabelul nr 2) include doua procese:
a) distructiv, generator de leziuni morfologice litice atat la nivel endo- si exocelular cat si interstitial, cu vicierea metabolismului tisular;
b) reactional, care prin migrare si proliferare celulara locala in zona lezionala, accentueaza procesele litice tisulare locale.
|
Natura agentului etiologic |
Exemplificare |
|
A. Biologici |
bacterii, virusuri, fungi, paraziti, |
|
B. Fizici |
traumatisme macanice, frig, caldura, radiatii, energie electrica |
|
C. Chimici |
diverse substante chimice in special acizi, baze, eteri, esteri |
|
D. Endogeni |
produsi: de retentie azotata; rezultati din necroza tisulara (enzime proteolitice, acizi organici, ROS) |
Tabelul 2 Clasificarea principalelor agensi etiologici a inflamatiei.
La actiunea diversilor agenti inflamatori, organismul raspunde printr-un complex de reactii (sindrom reactional) precum:
a) reactii vascular-circulatorii (vasoconstrictie initiala, urmata de vasodilatatie arteriolo-capilara si ulterior de staza vasculara pasiva), determinate in special de prostaglandine si prostacicline (fig. 6),
b) migrare si proliferare celulara
c) tulburare de permeabilitate cu aparitia fisurilor endoteliale si a edemului interstitial intraparietal la nivelul vaselor mici. Cresterea permeabilitatii este rezultatul actiunii factorilor vasoactivi eliberati prin activarea complementului pe cale alternativa, a produsilor citotoxici rezultati din degradarea celulara sau din activitatea metabolica si a factorului de crestere a permeabilitatii asociat cu cel globulinic de permeabilitate (globulina PF). Aceasta din urma se afla in plasma sub forma activa (pro-PF), fiind cuplat cu un inhibitor (IPF) cu care formeaza complexul PF/IPF. In focarul inflamator, IPF este inactivat, iar proPF este activat in contact cu factorul XII si cu proteinele modificate.
d) perturbarea metabolismului local, cu modificarea compozitiei plasmei si a homeostaziei fluido-coagulante. Dintre acestea, importante pentru consecintele generale din organism sunt oxidarea LDL si interactiunea asupra factorului de activare plachetara (PAF). Procesul de oxidare al LDL este realizat de catre sisteme oxidative precum cel al mieloperoxidazei si cel al 5-lipooxigenazei (fig 6)
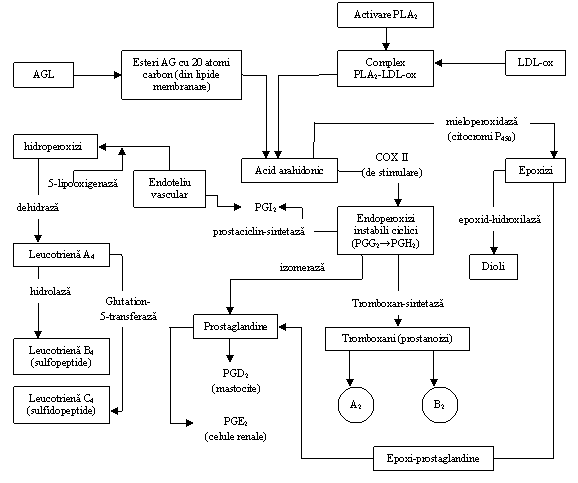
Fig 6 Actiunea sistemelor oxidative mieloperoxidaza, 5-lipooxigenaza si ciclooxigenaza II
C. Interactiunea patogenica: proces inflamator- spectru lipidic sanguin-endoteliu arteriolar
Indiferent de initiatorul oxidarii LDL serice, lipoproteinele cu densitate mica oxidate initiaza o serie de procese care conduc la aparitia inflamatiei vasculare si la formarea macrofagelor incarcate cu lipide, fenomen central al aterogenezei. Acestea au proprietati proinflamatoare determinand activarea limfocitelor T, iar prin epitopii nou formati au actiune antigenica determinand aparitia anticorpilor de tipul celor antifosfolipidici sau specifici anti-LDL oxidate.
LDL sunt asociate prin intermediul capatului terminal al apo-B100 cu fosfolipaza A2 secretata de celulele implicate in ateroscleroza si in inflamatie formand complexu fosfolipaza A2 -LDL (PL-A2-LDL). Aceasta enzima este denumita si acetil hidrolaza factorului de activare trombocitara. Enzima are specificitate pentru pentru fosfatidil-colinele oxidate generand cantitati crescute de AG oxidati si lizo-fosfatidil-colina (lizo-PC).-fig 6
Activitatea proaterogena a lizo-PC include:
activarea fenomenului de adeziune si agregare pe celulele endoteliului vascular, de molecule dar si de celule (leucocite, plachete etc)
perturbarea relaxarii dependente de endoteliu (actiune indusa prin prostaglandine si monoxidul de azot);
inductia fenomenului de chematoctism pentru monocite si pentru limfocitele T activate;
supresia productiei si eliberarii de monooxid de azot de catre celula endoteliala. Actiunea este expresia interventiei brandikininei (fig 7);
stimularea exprimarii de receptori pentru fragmentul C3 (al complementului intrinsec) activat pe cale alternativa, implicat atat in fenomenele imune cat si in cel de coagulare;
modularea proliferarii limfocitelor T si a macrofagelor;
cresterea productiei de oxigen in macrofagele intacte, cu inducerea stresului oxidativ pentru aceste celule.
Studiile biochimice si histologice au evidentiat ca LDL agregate inhiba apoptoza macrofagelor incarcate cu lipide (celulele spumoase) inducand exprimarea genei LIG (lipoprotein LDL inductibile gene).
Gena LIG codifica sinteza unei enzime implicata in degradarea proteinelor prin ubiquitinilare si care suprima apoptoza macrofagelor incarcate cu lipide.
D. Interactiunea fiziopatologica fenomen inflamator- perturbare a homeostaziei fluido-coagulante
Procesele inflamatorii indiferent de localizarea lor in raport cu placa de aterom coexistenta (la nivelul ateromului sau la distanta) stau la baza fenomenului clinic de destabilizare a placii de aterom, cu consecinta directa in instalarea accidentului vascular acut (cerebral, coronarian, periferic etc). Instalarea simptomatologiei clinice de accident vascular pe fond aterosclerotic, prin factorul favorizant, inflamatia, are la baza ca mecanism patogenic, preponderent ischemia regionala prin tromboza.
Tromboza trebuie considerata ca o ruptura locala" a echilibrului fluido-coagulant in favoarea coagularii. In patogenia acesteia intervin 3 factori
perturbarea specifica a factorilor plasmatici, cu actiune pro- sau anticoagulanta;
staza locala
leziunea endoteliala vasculara.
Desi procesele metabolice celulare din inflamatie actioneaza asupra ansamblului acestor factori predominanta este dereglarea sistemului pro-coagulant si a celui fibrinolitic.
a) Intre factorii procoagulanti fiziologici, care se modifica in cursul reactiei inflamatorii chiar din primele 24 de ore (reactanti de faza acuta a inflamatiei) se afla fibrinogenul (FI al coagularii). In inflamatia locala din ateromatoza, indiferent de stadiul evolutiv al acesteia, rapoartele ECAT (European concerted action on thrombosis and disabilities) sugereaza ca nivelul fibrinogenului este crescut local chiar daca nu sunt declansate reactii imunologice semnificative. In dinamica evolutiei procesului local endarterial, modificarea sa cantitativa agraveaza leziunile si predispune la instalarea evenimentului acut.
In cursul inflamatiilor sistemice cresterea nivelului fibrinogenului plasmatic, alaturi de alti reactanti de faza acuta modifica vascozitatea sangelui, diminuand viteza de flux sanguin local, elemente fizico-chimice pro-coagulante.
b) PLA2-LDL are specificitate pentru PAF si pentru fosfolipidele oxidate. Prin actiunea ei se obtine lizo-PAF si lizo-fosfatidilcoline (lizo-P). Lizo-PAF sub actiunea ROS generati de sistemul NADH/NADPH induc cresterea activitatii ERK1/2 (Kinaza activata extracelular cu promovarea ulterioara a proliferarii celulelor musculare netede vasculare, element histologic de ateromatoza.
c) Fiziologic, se descrie la nivelul peretelui arterial o activitate antitromboplastinica (inactiva sau sechestrata) care in conditii de lezare endoteliala, induce coagularea pe calea extrinseca, prin activarea acesteia, cu posibilitatea formarii trombusului local si declansarii evenimentului acut vascular.(fig. 7)
d) Proteina C reactiva (CRP), marker plasmatic al inflamatiei sistemice a fost incriminata ca factor biologic patogen al aterosclerozei, ca urmare a evidentierii prezentei acesteia in placa de aterom si a valorilor sale constant crescute in sindroamele coronariene acute.
Actiunea sa fiziologica s-ar datora:
asocierii CRP-LDL oxidate cu activarea complementului care induce: eliberarea histaminei cu cresterea permeabilitatii vasculare, favorizarea leucotaxiei, a diapedezei, precum si declansarea cascadei coagularii (actiune pro-trombogena);
efectului pro-trombogen realizat de catre nivelele plasmatice crescute ale CRP si prin actiunea de crestere a exprimarii factorului tisular, de catre nivel de monocite.
e) Perturbarea echilibrului fluido-coagulant prin procese inflamatorii se realizeaza si de catre activatorii eliberati de intima endoteliala, care au actiune fibrinolitica directa asupra plasminogenului (fig. 7)
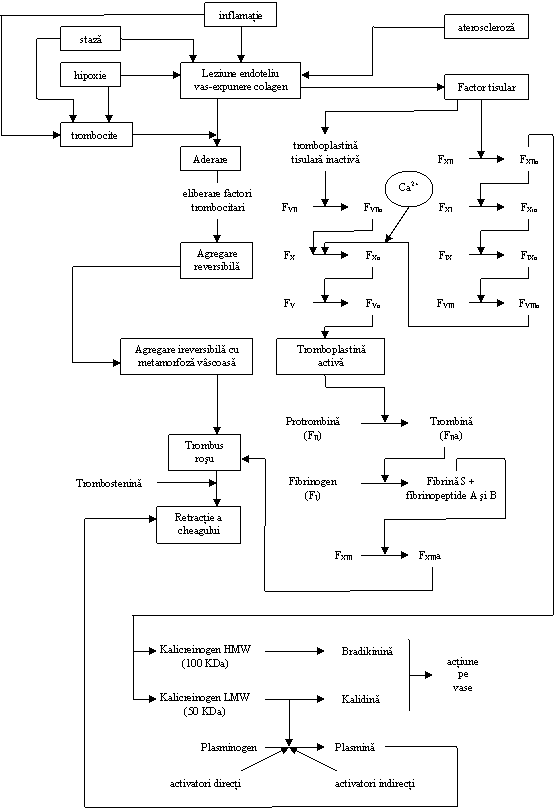
Fig. nr. 7 Mecanismele procesului coagularii
E. Periodontitele, factor de risc al afectiunilor cardiovasculare.
Relativ recent, periodontitele au fost redefinite ca un complex de alterari induse microbian (factorul proinflamator, factorul microbian) asociate cu disfunctii celulare, in care un rol important patogen revine ROS si enzimelor lizozomale.
a. Factorul microbian, ca agent etiologic al periodontitelor este reprezentat in special de catre microorganismele anaerobe care polueaza cavitatea bucala (Porphyromonas gingivalis) sau care suprainfecteaza mediul bucal oral (Prevatella migrescens, Fuso bacterium nucleatum, Troponema denticola.
b. Factorul inflamator local, mult mai intens in periodontitele active, decat in cele cronice, este rezultatul actiunii microbiene dar si al mediatorilor inflamatiei eliberati de catre sistemul mononuclear fagocitar. Acestia impreuna cu ROS sunt responsabili de prezenta leziunilor din tesuturile periodontale (din epiteliile jonctionale si creviculare) si de intensitatea activitatii osteoclastelor de la nivelul alveolei dentare. Numeroase studii atribuie periodontitelor prin incidenta lor ridicata (20% din populatie) rolul de factor de risc in evolutia aterosclerozei, in principal si a bolii ischemice coronariene sau a accidentelor vasculare cerebrale in special non hemoragice, in secundar.
Reprezentanti ai unor scoli prestigioase de medicina dentara precum cea din Helsinki sau din Carolina de Nord atribuie periodontitelor rol atat in patogenia formarii placii de aterom cat si in cea a declansarii si evolutiei evenimentelor cardiovasculare. Studiile comparate vizand pe de o parte mecanismele aterosclerozei, iar pe de alta parte pe cele din periodontitele acute si cronice au permis stabilirea unei corelatii intre gradul de agresivitate a leziunilor tisulare din suferinta orala si cele de ordin cardiovascular asociate.
Asocierea acestor afectiuni, in care periodontitele sunt potentiali factori de risc cardiovascular este demonstrata si de rezultatele care au monitorizat transversal indicatorii-markeri privind
a) prezenta inflamatiei: leucograma, VSH, nivelul plasmatic al proteinei C si al fibrinogenului;
b) dereglarea lipidica nivelul LDL-C si HDL-C-emiei, trigliceridemiei etc.
c) nivelul seric al anticorpilor: antiagenti infectiosi responsabili etiologic de aparitia periodontitelor sau antifosfolipidici specifici pentru LDL-oxidate
Cota de implicare a periodontitelor ca factori de risc in bolile vasculare a fost evaluata atat inainte cat si dupa tratamentul suferintelor inflamator- infectioase orale.
Rezultatele observatiilor vin in sprijinul ipotezei ca periodontitele netratate cresc riscul bolilor cardiovasculare si cerebrovasculare, in special de tip ischemic.
Studiile medicale din ultimii ani au stabilit reducerea capacitatii antioxidante la bolnavii cu periodontita, evidentiata prin prezenta unei concentratii reduse a glutationului in fluidul gingival crevicular, indusa posibil prin diminuarea sintezei sau a unei perturbari locale excesive.
De asemenea, a fost stabilita existenta unei corelatii negative intre concentratia HDL-C si forma clinica de periodontita (acuta sau cronica, tratata sau netratata). Astfel, se pot stabili corespondente intre frecventa crescuta a periodontitelor acute netratate si diminuarea potentialului antiaterogen a HDL cu cresterea riscului de cardiopatie ischemica sau de accident vascular arterial (cerebral, brahial etc.).
Corelatia negativa periodontita-boala vasculara degenerativa se concretizeaza in plan biologic umoral in reducerea HDL-C si a raportului subpopulatiilor HDL2/HDL3. In cursul infectiilor periodontale acute sau cronice au fost evidentiate modificari in distributia si compozitia subclaselor HDL, care dupa tratamentul adecvat al infectiei s-au corectat. S-a demonstrat ca modificarea valorii componentelor continute in subclaselor HDL este rezultatul unei intensificari a catabolismului lipoproteinelor cu densitate mare. Prin citokininele eliberate la nivelul inflamatiei, principala proteina a clasei HDL, apolipoproteina GLN II este dislocata pe amiloidul seric deoarece sinteza acesteia este reglata de catre citokine. Rezultatul afectarii acestui continut proteic, este reducerea procesului de esterificare a colesterolului cu cresterea depunerii sale la nivelul endarterial.
Pe de alta parte, in periodontite survine cresterea concentratiei de trigliceride din HDL, clasa lipoproteica modificata care are un ciclu separat de "evolutie metabolica". Cresterea survine ca urmare a diminuarii activitatii lecitil-colesterol-acil-transferazei, enzima care influienteaza pozitiv activitatea lipoproteinlipazei inducand eliberarea de trigliceride de la nivelul diverselor tesuturi.
Concluzii
Dupa admiterea patogeniei inflamatorii a aterosclerozei, studiile medicale efectuate in ultimii 5 ani asupra fiziopatologiei acestei boli degenerative contureaza o noua posibila realitate: factorul inflamator situat local (la nivelul placii de aterom) sau la distanta este un factor favorizant al destabilizarii placii de aterom cu consecinta directa asupra instalarii accidentului vascular.
Admiterea unei astfel de etiopatogenii a accidentelor acute coronariene sau cerebrale genereaza un nou "camp" de cercetare, concretizat in:
a) confirmarea acestei ipoteze prin studii ample, urmata de necesitatea identificarii unor markeri plasmatici ai inflamatiei relevanti pentru a permite evaluarea riscului aparitiei infactului miocardic sau a celui cerebral.
b) stabilirea pentru suferintele anterior amintite a unei noi metodologii terapeutice, pe trepte de prioritate (profilaxie si aspect curativ al episodului acut), prin utilizarea medicatiei anti-inflamatorii , imunomodulatoare si de tip antibiotic.
c) evaluarea utilitatii reducerii raspunsului inflamator prin tratament adecvat, cu scopul de a incetini evolutia aterosclerozei si a stabiliza ateromul deja constituit.
d) reamplasarea patologiei orale in raport de inportanta jucata in "economia " organismului, cu redistribuirea resurselor alocate (umane, tehnice, financiare) pentru reabilitarea cavitatii orale si necesitatea elaborarii pentru Romania a unui program national cu acest obiectiv.
Bibliografie
1.Amar I, Gokce H, Morgan S, Loukideli M, Van Duke E. Th, Vita AJ. Periodontal disease is associated with brachial artery endothelial dysfunction a systemic inflammation. Arter, Thromb. and Vascular Biology, 23:1245, 2003.
2. Battino M, Bullan P, Wilson M, Newman H. Oxidative injury and inflammatory periodontal disease: the challenge of antioxidants to free radicals and reactive oxygen species. Crit. Rev. Oral Biol., 10:458-476, 1999.
3. Beck DJ, Elter RJ, Heiss G, Couper D, Mauriello MI, Offenbacher S. Relationship of periodontal disease to carotid artery intima media wall thickness. Arter, Thromb. and Vascular Biology, 21:1816-1822, 2001.
4. Buckmann R, Hasilik A, Van Duke TE, Lange De. Amplified crevicular leukocyte activity in aggressive periodontal disease. J. Dent. Res, 81:716-721, 2002.
5. Chau B. Multiple infections in carotid atherosclerotic plaques. Ann Heart J, 138:8534-8536, 1999.
6. Danesh J, Collins R, Peto R. Chronic infections and coronary heart disease is there a link? Lancet, 350:430-436, 1997.
7. DeStefano F, Anda RF, Kahn HS, Williamson DF, Russel MC. Dental disease and risk of coronary heart disease and mortality. BMJ, 306:688-691, 1993.
8. Dragomirescu M, Novac E, Buzinschy S. Patogenia infectiilor. Ed. Facla Asclepios. Timisoara, 1980.
9. Duncan GG. Bolile metabolismului.Ed. Medicala, Bucuresti 1966.
10. Epstein SE, Zhan YF, Zhu J. Infection and atherosclerosis emerging mechanistic paradigms. Circulation, 100:e20-e28, 1999.
11.Fredrickson DS. In: Lipid, metabolism, obesity and diabetes mellitus: Impact upon atherosclerosis. Edit. Greten H, Leoine R, Pfeiffer EF, Renold AE, Georg Thieme. Verlag. Stuttgard, 1974.
12.Fredrickson DS. An international classification of hyperlipidemias and hyperlipoproteinemias. Ann. Intr. Med. 75, 1971.
13. Fredrickson DS, Levi RI, Lees RS. Fat transport in lopoproteins. An integrated approach to mechanism and disordes. New Engl J Med 276, 1967.
14. Gesormell E, Yamazaki K, Seymour GJ. Destructive periodontitis lesions are determined by the nature of the lymphocytic response. Crit. Rev Oral Biol Med, 13:17-34, 2002.
15. Gordon DJ, Rifkind BK. High density lipoprotein -the clinical implications of recent studies. N Engl J Mol. 321:1311-1316, 1989.
16. Groeneveld AB, Raijmakers PG, Rauwerda JA, Hack CE. The inflammatory response to vascular surgery- assocaited ischamia and reperfusion in man: effect on postoperative pulmonary function. EUR J Vasc Endovasc Surg 14:351-358, 1997.
17. Hamberg M, Svenssen J, Samuelsson B. Thromboxane:a new group of biologically active compounds derived from prostaglandin endoperoxides. Proc Nat Acad Sci USA 72, 1975.
18. Horter MJ, Sondermann S, Reinecke H, Bogdanski J, Woltering S, Kerber G, Breithardt G, Assmann G, Von Eckardstein A. Associations of HDL phospholipids and paraoxonase activity with coronary heart disease in postmenopausal women. Acta Phisiol Scand, 176, 123-130, 2002.
19. Janket SJ, Qvarnstrom M, Meurman J, Baird EA, Neutinen P, Jones AJ. Asymptotic dental scor and prevalent coronary heart disease. Circulation, 1-6, 2004.
20. Lackie B. Stress on the renine gene. Nature, 344:194-197, 1990.
21. Luc G, Douste Blazy P, Frucharz JC. Le cholesterol: d'an il vient, comme circule-t-il, an va-t-il? Rev Prat, 12:3149-3157, 1989.
22. Mackness MI, Durrington PH, Mackness B. How high density lipoprotein protects against the effect of lipid peroxidation. Curr Opin Lipidol, 11:383-388, 2000.
23. Manole Gh. Fiziopatologie clinica generala -vol I, Ed. Coresi. Bucuresti, 2002.
24. Manole Gh. Fiziopatologie clinica generala (vol II- Fiziologia organelor), Ed. Coresi. Bucuresti, 2003.
25. Mattila K, Vesamen M, Valtonen V, Nieminen M, Palasno T, Rasi V, Asikainen S. Effect of treating periodontitis on C- reactive protein levels: a pilot study. B.M.C. Inf. Dis., 2:30-32, 2002.
26. Muicu I, Hancu N. Dislipidemiile. Lipidologie clinica. Ed. Medicala, Bucuresti 1967.
27. Moldoveanu E, Popescu LM. Apoptoza- mecanisme moleculare. Ed. Universitara "Carol Davila", Bucuresti 1993.
28. Moldoveanu E. Biochimie medicala. Ed. Printech, Bucuresti, 2001
29. Nieminen A, Nordlund L, Uitto VJ. The effect of treatment on the activity of salivary proteases and glycosidases in adults with advanced periodontitis. J Periodontal, 64:297-301, 1993.
30. Noiri Y, Li L, Ebisn S. The localization of periodontal disease- associated bacteria in human periodontal pockets. J Dental Researsch, 80:1930-1934, 2001.
31. Piper PJ. Pharmacology of leucotrienes. Brit Med Bull, 39,156-163,1983.
32. Pussinen JP, Jausilahti P, Alfthan G, Palosuo T, Salomma V. Antibodies to periodontal pathogens are associated with coronary heart disease. Arter Thromb and Vascular Biology, 23:1250, 2003.
33. Pussinen JP, Jausilahti P, Vilkuna-Rautiainen T, Sundvall J, Vesanen M, Mattila K, Palosuo T, Alfthan G. Periodontitis decreases the antiatherogenic potency of high density lipoprotein. J Lipid Research, 45:139-147, 2004.
34. Pussinen JP, Metso J, Malle E, Barlage S, Palosuo T,.Sattler W, Schmitz G, Jauhiainen M. The role of plasma phospholipid transfer protein (PLTP) in HDL, remodelling in acute- phase patients. Biochim Biophys Acta, 1533:153-163, 2001.
35. Pussinen JP, Metso J, Malle E, Barlage S, Sattler W, Raynes JG, Jauhiainen M. Acute- phase HDL in phospholipid transfer protein (PLTP) -mediated HDL conversion. Athelosclerosis, 155:297-305, 2001.
36. Shikhman AR, Brinson DC, Lotz M. Profile of glycosaminoglycan degrading glycosidases and glycoside sulfatases secreted by human articular chondrocytes in homeostasis and inflammation. Arthritis Rheum, 43:1307-1314, 2000.
37. Skipski VP. In Blood lipids and lipoproteins: quantitation composition and metabolism. Ed. GR Nelson, Wailey J & Sons Inc. New York, 1972.
38. Slats J. Actinobacillus actinomycetemcomitans and Porphyramanos gingivalis in periodontal disease: introduction. Periodontolog, 20:7-13, 2000.
39. von Eckardstein A, Hofer JR, Assmann G. High density lipoproteins and artheriosclerosis. Arteriosch. Tromb. Vasc. Biol, 21:13-21, 2001.
40. Wehrmacher W. Periodontal disease predictive and possible contributive to acute myocardial infection. Dent Today, 20:80-81, 2001.
41. Wolfe LS. Eicosanoids: prostaglandins thromboxanes, leukotrienes and other derivatives of carbon-20-unsaturated fatty acids. J Neurochem. 38, 1982.
42. Wu T, Trevisan M, Genco RJ, Dom JP, Falkner KL, Sempos CT. Periodontal disease and risk of cerebrovascular disease: the first national health and nutrition examination survey and its follow-up study. Arch Intern Med 160, 18, 2749-2755, 2000.
43.Anuarul statistic al Romaniei, 2002.
44.American Academy of Periodontology-Periodontal diseases : pathogenesis and microbial factors. World Workshop in Periodontics. Consensus report Ann periodontol 1:926-932, 1996.
45.American Academy of Periodontology- Parameter on aggressive periodontitis. J Periodontol,71:867-869, 2000.
|
Politica de confidentialitate | Termeni si conditii de utilizare |

Vizualizari: 2482
Importanta: ![]()
Termeni si conditii de utilizare | Contact
© SCRIGROUP 2026 . All rights reserved