| CATEGORII DOCUMENTE |
| Aeronautica | Comunicatii | Electronica electricitate | Merceologie | Tehnica mecanica |
HIDROLAZE IMPORTANTE IN INDUSTRIA ALIMENTARA
Hidrolazele sunt enzime care catalizeaza scindarea hidrolitica a substraturilor, determinand desfacerea legaturilor dintre atomii de carbon si alti atomi prin introducerea elementelor apei. Principalele legaturi scindate la hidrolaze sunt legaturile: ester glicozidazica si peptidica.
1. Lipaze si esteraze
Enzimele lipolitice sint importante in metabolismul si degradarea lipidelor. Importanta lor fiziologica consta in aceea ca hidrolizeaza grasimile alimentare cu formare de di-, monogliceride si acizi grasi, produsi care sint transportati, oxidati si sintetizati in gliceride si fosfolipide proprii organismului. Importanta lor tehnologica consta in faptul ca realizeaza hidroliza controlata a lipidelor, in vederea formarii de arome in cadrul alimentelor (de exemplu,, in cazul branzeturilor) sau in sisteme pregatite special pentru obtinerea de aromatizanti. Enzimele lipolitice sunt implicate insa si in degradarea unor produse alimentare cu continut ridicat in lipide (lapte si produse lactate, carne, peste, produse vegetale bogate in lipide, cum ar fi arahidele, seminte de floarea soarelui, soia, germeni de griu si porumb etc.).
Lipazele se diferentiaza de esteraze prin afinitatea lor mai mare pentru acizii grasi cu lant lung din structura gliceridelor. Pe de alta parte, pe plan structural, lipazele prezinta o portiune hidrofila si alta lipofila, fapt ce le permite plasarea lor la interfata ulei/apa, actiunea lor fiind favorizata de calitatea emulsiilor de tipul ulei/apa. Sarurile de calciu si proteinele sunt activatori (efectori) ai lipazelor. In cazul lipazelor din sucul pancreatic, rol de activator il au si sarurile acizilor biliari.
Enzimele lipolitice de tipul lipazelor si fosfolipazelor sunt prezente ca enzime endogene in diferite tesuturi animale, lapte, produse vegetale.
Laptele contine o lipaza (cea mai importanta) care are pH optim la 8,5-9 si alte 2-3 lipaze care includ si o lipaza acida. Proteinele din lapte au actiune inhibitoare fata de lipaze. Clorura de calciu (CaCl2) inhiba semnificativ lipazele din lapte. Lipazele din lapte hidrolizeaza rapid trigliceridele simple, viteza de hidroliza micsorindu-se o data cu cresterea lantului de acid gras din structura trigliceridei. Lipazele din lapte poseda si activitate de sinteza:
glicerol + acid gras → gliceride + apa
Sinteza gliceridelor este influentata de concentratia enzimei, concentratia glicerolului, temperatura si durata incubarii.
Fructele si legumele, dar in special semintele de griu, ovaz, secara, soia etc., contin lipaze care provoaca deteriorari ale acestora in conditii nefavorabile de umiditate relativa mare a aerului, continut mare de umiditate al cerealelor, temperatura ridicata. Datorita cresterii continutului de acizi grasi liberi scad proprietatile de panificare a fainurilor de griu. Germenii de griu, secara, orz au o activitate lipolitica mai mare decit endospermul, deci sunt mai bogati in lipaze. Scutelum si stratul aleuronic, de asemenea, contin mai multe lipaze decit endospermul.
Lipazele produse de microorganisme sint produse de drojdii (Candida, Torulopsis) , mucegaiuri (Rhizopus, Penicillimmi, Aspergillus, Geotrichum, Mucor), bacterii (Pseudomonas, Achromobacter, Staphylococcus). Lipazele din microorganisme difera intre ele prin pH si temperatura optima de activitate, durata/temperatura de inactivitare, respectiv stabilitatea termica.
Lipazele produse de microorganisme sint considerate ca lipaze adevarate care hidrolizeaza grasimile si uleiurile naturale ca si gliceridele sintetice. Concentratii scazute de saruri de Ca, Na, K, Mg activeaza lipazele, dar metalele grele sint inhibitori puternici.
Avind in vedere actiunea negativa a lipazelor asupra caracteristicilor senzoriale ale produselor alimentare, este necesar sa se ia urmatoarele masuri:
- sa se reduca continutul in apa libera al produsul alimentar (acolo unde este posibil), pentru a micsora activitatea apei (aw), deci pentru micsorarea vitezei reactiilor enzimatice;
- sa se pastreze produsele alimentare la temperaturi cat mai scazute (de refrigerare sau congelare) sau sa se inactiveze lipazele prin tratament termic ;
- sa se reduca timpul de depozitare al materiilor prime ;
- sa se elimine factorii care concura la dezvoltarea microflorei lipolitice.
2. Enzime oligozidazice
Dintre oligozidaze, mai importante pentru industria alimentara sunt b-glucozidaza (EC 3.2.1.21), a-D-galactozidaza (EC 3.2.1.22), b-D-galactozidaza (EC 3.2.2.23), b-D-fructofuranozidaza (EC 3.2.1.26).
b-Glucozidaza (EC 3.2.1.21), denumita si emulsina, scindeaza legatura b-glucozidica din b-glucozii raspinditi in plante cum ar fi amigdalina, prunazina, naringina, dar si din celobioza si gentiobioza. Aceasta enzima este produsa si de unele microorganisme: Alcaligenes faecalis, Botryodiplodia theobromae, Phoma strasseri, Septoria licopersici, Aspergillus niger, Myrothecium verucaris, Trichoderma viride, Saccharomyces lactis etc.
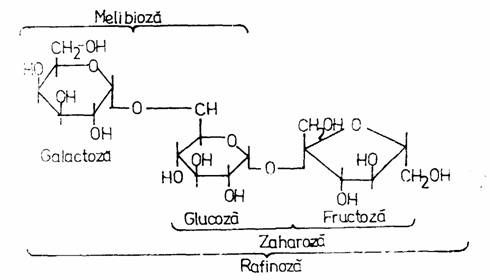
a-D-Galactozidaza (EC 3.2.1.32) este prodsua de B. stearothermophilus, Penicillium duponti, Absidia griseola, Mortierella vinaceae, Aspergillus awamori. Substratul natural al acestei enzime este rafinoza, trizaharid format din galactoza, glucoza si fructoza. Enzima desface rafinoza in galactoza si zaharoza si are aplicatii in industria zaharului si industria derivatelor proteice vegetale.
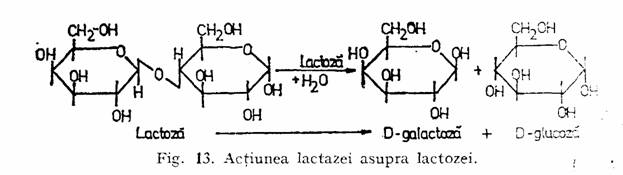
b-D-Galactozidaza (EC 3.2.2.23), cunoscuta si sub numele de lactaza hidrolizeza lactoza la glucoza si galactoza (fig. 13). Este gasita in unele plante, microorganisme si in mucoasa intestinala a mamiferelor. Este obtinuta din tulpini de mucegaiuri (Aspergillus niger, Aspergillus oryzae, Aspergillus foetidis), din drojdii (Kluyveromyces fragilis, Kluyveromices lactis, Candida pseu-dotropicalis, Torulopsis lactis) si bacterii (Lactobacillus bulgaricus, Streptococcus thermophilus, Escherichia coli).
Preparatele lactazice din drojdii actioneaza bine la pH ≈6 si la temperatura de 35 40C, deci la pH-ul substratului natural (lapte degresat, lapte concentrat), cele de origine fungica au activitate maxima la pH ≤ 5 si la temperatura de 50 60 'C, fiind recomandate pentru hidroliza lactozei din zer. Din Aspcrgillus oryzae si Aspergillus niger se obtin lactaze acidoactive si acidostabile, folosite la hidroliza lactozei in mediu acid. Lactaza de origine bacteriana (E. coli) actioneaza bine la pH ~ 7,3 si la 46 C. Ionii de sodiu si potasiu sint activatori ai lactazei din E. coli si din drojdii.
Preparatele enzimatice de lactaza se utilizeaza pentru obtinerea de produse lactate destinate si adultilor care prezinta intoleranta la lactoza (deficienta congenitala, primara sau secundara de lactaza), pentru obtinerea siropului'de lactoza ce are multiple aplicatii in industria alimentara, pentru impiedicarea aparitiei unor defecte in produsele lactate concentrate si congelate. Se utilizeaza si in panificatie, in cazul utilizarii zerului pulbere la fabricarea piinii.
3. Amilaze
Amidonul, cel mai important homoglucid de rezerva din regnul vegetal, se gaseste in diferite materii prime folosite in industria alimentara, de obicei sub forma de granule, in cele doua componente principale, amiloza si amilopectina, care sint dispuse in straturi concentrice, fiind insotite de mici cantitati de alte substante organice (protide, lipide) si substante anorganice (H3PO4, Si03, H2O). Amiloza care reprezinta 20-25% din amidon, este alcatuita din unitati de glucoza legate intre ele prin legaturi α l-4 glucozidice, gradul de polimerizare fiind de 200-6000 (in medie 103). Amilopectina care reprezinta 75-80% din amidon este formata din lanturi liniare de glucoza legate α l-4 glucozidic, lanturi care se grefeaza unele pe altele prin legaturi α l-6 glucozidice. Numarul legaturilor α l -6 glucozidice reprezinta 5-6% din ansamblul de legaturi din amilopectina, gradul de polimerizare al acesteia fiind de 105-109 resturi de glucoza.
Sub forma de granule, amidonul este rezistent la actiunea enzimelor amilolitice. In general, enzimele amilolitice actioneaza numai in conditiile in care granulele de amidon sunt cel putin lezate (de exemplu in cazul amidonului din cereale supuse macinarii) si mai ales cind amidonul a fost gelificat prin incalzire in prezenta de apa, realizindu-se pe aceasta cale o hidratare, o umflare si deci o spargere a granulelor de amidon. Sub aceasta forma amidonul devine usor atacabil de enzimele amilolitice care, actionind asupra amilozei si amilo-pectinei, produc desfacerea hidrolitica a legaturilor α l-4 glucozidice, determinand depolimerizarea acestora si formarea de dextrine de diferite marimi, maltoza, glucoza.
Enzimele implicate in degradarea amidonului pot fi endogene, care se gasesc in cantitate mai mare in cereale incoltite, importante in cazul orzului ce este transformat in malt, si exogene, care in cea mai mare parte sunt de natura bacteriana sau fungica. Amilazele sunt bine caracterizate si diferentiate pe baza tipului de legatura hidrolizata, modul lor de atac (endo sau exo), natura substratului limita si produsii de degradare. Enzimele care ataca amidonul sint glucozilhidrolaze si apartin urmatoarelor grupe:
a) Enzime care hidrolizeaza legaturile a l-4 glucozidice
a.-Amilaza, cunoscuta si sub denumirea de amilaza dextrinogenica, diastaza, ptialina, glucogenaza, a-l,4-glucon 4-glucanohidroxilaza (EC 3.2.1.1.), este o metalproteina care contine calciu in proportie de l atom gram/molecula, strins legat de enzima. Prin indepartarea calciului, enzima devine inactiva si instabila la caldura. Calciul nu participa direct la formarea complexului enzima-substrat, dar mentine molecula de enzima in configuratia optima pentru un maxim de activitate si stabilitate, (in practica de hidroliza a amidonului se adauga calciu sub forma de saruri). Enzima are activitate la pH cuprins intre 4,5 si 7,0, pH-ul optim depinzind de originea enzimei. Stabilitatea la caldura este de asemenea diferita in functie de originea enzimei. α-Amilaza hidrolizeaza mai mult sau mai putin la intimplare legaturile a l-4 glucozidice din interiorul moleculelor de amiloza si amilopectina, conducind la dextrine de diferite marimi, respectiv la lichefierea amidonului si la o hidroliza prelungita si la maltoza si maltotrioze.
a-Amilazele pot fi de origine animala (amilaza produsa de glanda salivara si pancreas), de origine vegetala (cereale incoltite in special malt) cu importanta in industria berii, spirtului si panificatiei si de origine microbiana (bacterii, mucegaiuri si mai putin drojdii), cele de origine bacteriana fiind mai stabile la caldura decit cele de origine fungica.
b-Amilaza, denumita si amilaza zaharigenica, α l-4 glucano-maltohidrolaza (EC 3.3.1.2) hidrolizeaza legaturile α l-4 glucozidice ale amidonului de la capetele nereducatoare ale lanturilor poliglucidice (este exoenzima). Amiloza cu numar impar de unitati de glucoza este transformata in maltoza in proportie de 90% si in maltotrioze. La concentratii mari ale enzimei si la hidroliza prelungita, maltotrioza este degradata lent la glucoza si maltoza. Amilopectina este degradata si ea in maltoza dar hidroliza se opreste la legaturile α l-6 glucozidice care nu pot fi hidrolizate si nici by-passate. Se formeaza in acest fel 60-70% maltoza, restul fiind dextrine limita. b-amilaza are pH-ul optim intre 5 si 6 iar temperatura optima ~55 63 C. Pentru activitatea enzimatica sint necesare gruparile -SH.
Surse importante de b-amilaza sunt orzul, graul, secara, cartofii dulci si soia. Recent s-a dovedit ca este produsa si de unele microorganisme (Bacillus, Streptomyces ), avind pH-ul optim la 5-6 si temperatura optima la 60 C.
b) Enzime care hidrolizeaza legaturile α l-6 glucozidice. Sunt cunoscute si sub denumirea de enzime de debransare (deramificare) ce actioneaza asupra arnilopectinei din amidon, in cadrul acestora sint mai bine cunoscute urmatoarele enzime:
- pullulanaza (EC 3.2.1.41), care hidrolizeaza poliglucidul pullulan, conducind la eliberarea de maltotrioza. Actioneaza, de asemenea, si asupra legaturilor α l -6 glucozidice din amilopectina si in mai mica masura asupra celor din structura glicogenului. Este produsa de numeroase microorganisme, dar se extrage, in principal, din Klebsiella aerogenes.
- izoamilaza (EC 3.2.1.68) poate deramifica atit amilopectina cit si glicogenul. Actioneaza foarte slab asupra pullulanului. Este produsa de specii dePseudomonas si Citophaga. Aceste doua enzime de deramificare pot completa 100% actiunea de dextrinizare si zaharificare a amidonului produsa de α si β amilaze. Ca si b-amilaza, enzimele de deramificare nu actioneaza asupra amidonului negelificat.
c) Enzime care hidrolizeaza atit legaturile a l-4cit si a l-6 glucozizidice. In cadrul acestora o deosebita importanta o prezinta: glucoamilaza ce hidrolizeaza mai repede legaturile α l-4 dar si cele α l-6 de la capetele nereducatoare ale lanturilor poliglucidice din amidon, conducind la glucoza. Randamentul de transformare a amidonului in glucoza este afectat de capacitatea enzimei de a polimeriza glucoza la maltoza si maltotrioza, reactie care este dependenta de concentratia ridicata a substratului. Preparatele comerciale de amiloglucozidaza sint de origine fungica (Aspergillus, Rhizopus), fiind impurificate cu lipaze, tanaze, celulaze, hemicelulaze, proteaze.
Enzime pectolitice
Enzimele care actioneaza asupra substantelor pectice pot fi clasificate in doua grupe: enzime saponifiante sau pectinesteraze si enzime depolimerizante sau pectinglicozidaze.
Pectinesterazele (pectinmetilesteraza - pectindemetoxilaza, pectinpectilhidrolaze, EC 3.1.1.11), notate PME sau PE, hidrolizeaza esterul metilic al acidului galacturonic.
Pectinesterazele se gasesc in diferite produse vegetale (tomate, ceapa, pepeni, mere, pere etc.) si au un optim de pH aproape de neutralitate. De exemplu, pectinesterazele din tomate si citrice au pH-ul optim la 7,5, cele din mere la 6,6 si cele din struguri la 5,6. Sint relativ stabile la caldura.
Pectinglicozidazele sunt enzime depolimerizante. Preparatele enzimatice pectolitice sint utilizate in mare masura pentru ameliorarea extractiei sucului celular din fructe si legume (prin degradarea peretilor celulari), pentru macerarea fructelor si legumelor in vederea obtinerii de nectaruri (prin degradarea substantelor pectice ale lamelelor mijlocii care asigura legatura dintre celule, fara a se distruge peretii celulelor parenchimatoase) si pentru limpezirea (clarificarea) diferitelor categorii de sucuri.
In cazul preparatelor enzimatice pectolitice folosite pentru macerare, este necesar ca acestea sa posede si activitate celulazica, hemicelulazica, proteazica si amilazica.
5. Peptidhidrolaze (proteinaze si peptidaze)
Peptidhidrolazele - proteinazele si peptidazele - cunoscute si sub denumirea generala de enzime proteolitice catalizeaza scindarea hidrolitica a legaturilor peptidice, din moleculele proteidelor, polipeptidelor si oligopeptidelor, conducind la eliberarea de peptide de diferite mase moleculare, sau chiar la aminoacizi, dupa urmatoarea reactie generala:
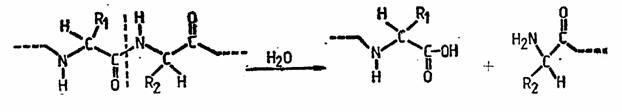
In functie de regiunea din molecula proteidelor sau polipeptidelor la nivelul careia actioneaza, acestea se subdivid in endo- si exopeptidhidrolaze ; endo-peptidhidrolazele, denumite si proteinaze sau peptidilpeptidhidrolaze, scindeaza hidrolitic legaturile peptidice din interiorul catenelor polipeptidice ale proteidelor si proteinelor cu masa moleculara mare, producand catene polipeptidice de masa moleculara mai mica, iar exo-peptidhidrolazele, peptidazele sau exopeptidazele catalizeaza desfacerea hidrolitica a legaturilor peptidice de la extremitatile catenelor polipeptidice sau oligopeptidice, conducind, in general, la eliberarea de aminoacizi. Exo-peptidazele pot actiona atat asupra produsilor de hidroliza a endo-peptidhidrolazelor cat si asupra unor proteine nehidrolizate. La rindul lor, exopeptidazele, se subdivid in aminopeptidaze, care desfac hidrolitic aminoacizii de la capetele N terminale ale catenelor peptidice (corespunzatoare resturilor de aminoacizi cu gruparea -NH2 libera) si carboxipeptidaze ce scindeaza hidrolitic aminoacizii de la capetele C terminale (corespunzatoare resturilor de aminoacizi cu gruparea -COOH libera).
In cadrul exo-peptidazelor se grupeaza si dipeptidazele, care desfac legaturile peptidice din dipeptide, precum si dipeptidil-peptidhidrolazele, care scindeaza dipeptide de la capatul N terminal al lantului polipeptidic si peptidil-dipeptidhidrolazele ce elibereaza dipeptide din capatul C terminal.
In cazul endo-peptidhidrolazelor, luindu-se in considerare unele grupari functionale din centrii activi ai enzimelor, comportarea fata de unii inhibitori sau activatori si efectul pH-ului, se pot distinge:
- proteinaze serinice, care au in centrul activ un rest de serina si care sunt inhibate de unii compusi organofosforici; acestui grup ii apartin: tripsina, chimotripsina, elastaza, subtilizina (din Bacillus sp.), proteinaza alcalina din Aspergillus sp. etc.;
- proteinaze tiolice sau SH-dependente, care au in centrul activ grupari -SH libere, corespunzatoare resturilor de cisteina si care pot fi inactivate prin blocarea acestora cu metale grele, cu agenti alchilanti sau oxidanti; din cadrul acestora fac parte: papaina, ficina si bromelina;
- proteinaze carboxilice (acide) al caror centru activ cuprinde grupari carboxilice ionizate si care sunt active in domeniu de pH acid; din acest grup fac parte proteinazele care coaguleaza laptele, chimozina, pepsina, proteinazele produse de Mucor sp., precum si proteinazele acide produse de Aspergillus sp. ;
- metal-proteinaze, care sunt activate de ioni metalici legati de centrul activ (ca, de exemplu, Ca2+, Zn2+, Mg2+, Fe2+); din grupul acestora fac parte: colagenazele, proteinaza neutra produsa de Bacillus subtilis, sau Aspergillus oryzae etc.
Dintre peptidhidrolazele vegetale :
Papaina. Sub denumirea de papaina se intelege preparatul brut ce se colecteaza din fructele de Caryca papaia, cu putin inainte de coacerea acestora. Latexul colectat in contact cu aerul se coaguleaza, dupa care se usuca sub vid, se macina si se cerne. Preparatul brut de papaia contine de fapt trei fractiuni: papaina propriu-zisa (10%), chimio-papaina (45%) si lizozim (20%), ultima fractiune fiind denumita si papain-peptidaza. Aceste fractiuni difera intre ele prin masa moleculara si punctul izoelectric.
Papaina propriu-zisa este o proteinaza tiolica constituita dintr-un lant polipeptidic format din 212 resturi aminoacizi. Papaina are o activitate specifica larga hidrolizind atit peptidele mici cit si proteinele. Este foarte activa in hidroliza amidelor si esterilor. Are pH-ul optim in jur de 6. Papaina are o stabilitate buna.
Chimopapaina. A fost obtinuta in stare cristalizata din latexul de papaya si este formata din chimopapaina A si B. Are actiune asemanatoare cu papaina, insa este mai putin eficace asupra hemoglobinei si este mai stabila decit papaina. Chimopapaina isi pierde 50% din activitatea sa daca este mentinuta 75 min la 75C (pH = 7,2), fata de 56 min pentru papaina.
Preparatul brut de papaina ataca relativ bine fibrele musculare si pe cele elastice dar mai putin pe cele de colagen.
Bromelina. Este o enzima proteolitica cu actiune energica care se gaseste in sucul de ananas. Ca si papaina si ficina, bromelina este o sulfhidril-proteaza, insa are structura unei glicoproteine. Optimul de activitate este la pH = 6,3 si la 55C. Are o actiune buna asupra fibrelor de colagen, dar o actiune slaba asupra celor elastice. Actiunea asupra fibrelor musculare este foarte redusa.
Peptidhidrolazele de origine animala mai bine cunoscute si mai des folosite sint: chimozina, pepsina si tripsina, carora li se adauga chimotripsina, elastaza si carboxipeptidazele, aminopeptidazele si dipeptidazele, produse de diferite glande digestive. Cu exceptia ultimelor doua tipuri de exo-peptidaze, celelalte peptidhidrolaze sunt produse de glandele digestive sub forma de pro-enzime (preenzime sau zimogene) inactive, care devin active numai in urma scindarii hidrolitice a unor portiuni din structura lor, ce blocheaza activitatea lor enzimatica. Conversia proenzimelor in enzime active se realizeaza pe cale autocatalitica, care conduc la enzima activa si fragmente polipeptidice inactive enzimatic.
Chimozina. Cunoscuta si sub denumirea de cheag, rennina, presura sau labferment, chimozina constituie un preparat enzimatic cu actiune coagulanta (asupra laptelui) si proteolitica, asemanator pepsinei, obtinut din stomacuri de vitel, miel sau ied, folosit in special la prepararea brinzeturilor. Chimozina rezulta din precursorul inactiv - prochimozina - produsa de mucoasa stomacului glandular (al patrulea stomac al viteilor) prin hidroliza partiala, proces influentat de pH si concentratia in saruri.
Chimozina este o preteaza serinica, cu specificitate de actiune similara pepsinei, actionind mai ales la nivelul legaturilor peptidice in care sunt implicate resturi de triptofan, fenilalanina, tirozina, metionina si leucina; manifesta activitate coagulanta si proteolitica.
Pepsina. Endo-peptizada produsa sub forma de pepsinogen de glandele stomacale ale mamiferelor inclusiv ale omului si care se gaseste si in sucul gastric al pasarilor, reptilelor si pestilor, pepsina scindeaza hidrolitic legaturile peptidice din interiorul catenelor polipeptidice ale proteinelor, actionind de preferinta la nivelul legaturilor peptidice in care sunt implicati aminoacizi aromatici (fenilalanina, tirozina sau triptofan) si dicarboxilici (acizii glutamic si aspartic). Transformarea pepsinogenului in pepsina catalitic activa se realizeaza la pH mai mic decit 5, in prezenta ionilor H+ sau a unor mici cantitati de pepsina, activarea fiind insotita de eliberarea unui polipeptid alcatuit din 29 de resturi de aminoacizi, care actioneaza ca inhibitor al pepsinei, si cinci peptide mici. Pepsina este constituita dintr-un singur lant polipeptidic cu un rest izoleucinic la capatul N terminal si un rest de valina la capatul C terminal. pH-ul optim de actiune este 1,5-2,5. Este folosita la precipitarea cazeinei, obtinerea de peptone, in unele tari pentru limpezirea berii la rece, ca adjuvant digestiv si este inclusa in reteta de preparare a unor bauturi tonice si a chewing-gum-ului.
Tripsina. Este tot o endo-peptidaza, care desface hidrolitic legaturile peptidice in interiorul catenelor polipeptidice, de preferinta cele constituite intre gruparea carboxil a unui aminoacid diaminic (arginina, lizina) si gruparea aminica a altui rest de aminoacid. Este produsa de pancreas sub forma de tripsinogen, forma inactiva, care se transforma in tripsina activa in intestinul subtire sub actiunea enterochinazei (o enzima intestinala) sau pe cale autocatalitica, in prezenta unor mici cantitati de tripsina. Tripsina este constituita din 223 resturi de aminoacizi a caror secventiabilitate este cunoscuta. Actioneaza la pH neutru, slab alcalin, pH-ul optim fiind 8,5.
In ultimele decenii, datorita dezvoltarii impetuoase a proceselor si instalatiilor de cultivare a microorganismelor la nivel industrial, pentru realizarea de diferite produse (antibiotice, vitamine, preparate enzimaticc etc.) pe cale biosintetica, s-a inregistrat un interes deosebit si pentru cercetarea si obtinerea de preparate peptidhidrolazice din microorganisme, in special din bacterii si fungi. Interesul pentru astfel de preparate proteolitice a crescut si mai mult dupa anul 1965, cind s-au folosit astfel de preparate pentru obtinerea de detergenti cu enzime, de tip Biotex, care contin proteaze produse de Bacillus licheniformis.
Multe din microorganismele folosite la producerea de preparate proteolitice produc aceste enzime extracelular, secretandu-le in lichidele de cultura, ceea ce usureaza foarte mult conditiile de prelucrare industriala pentru obtinerea de preparate enzimatice. Datorita acestor fapte, exista in prezent tendinta ca o serie de preparate proteolitice de natura vegetala sau animala sa fie inlocuite din ce in ce mai mult cu preparate proteolitice microbiene, care sunt in general mai ieftine si de o mai mare diversitate.
In prezent sint cunoscute numeroase tulpini de microorganisme care secreta in mediile lor de cultura cantitati apreciabile de enzime proteolitice; dintre acestea, insa, sunt folosite pentru obtinerea de preparate proteazice numai tulpinile nepatogene si care nu produc toxine. De mai multi ani, in diferitele sectoare ale industriei alimentare, se folosesc proteaze obtinute mai ales prin cultivarea unor microorganisme ca: Bacillus subtilis, Bacillus licheniformis, Bacillus megaterium, Aspergillus niger, Aspergillus oryzae, Streptomyces sp., Rhizopus sp., Byssoclamys fulva, Endothia parasiica, Mucor niiehei, Mucor pusillus etc.
Proteinazele microbiene nu sunt, in general, foarte diferite de cele vegetale sau animale; apartin si ele serin - sulfhidril- si carboxil-proteinazelor, precum si metalo-proteinazelor.
|
Politica de confidentialitate | Termeni si conditii de utilizare |

Vizualizari: 4567
Importanta: ![]()
Termeni si conditii de utilizare | Contact
© SCRIGROUP 2026 . All rights reserved