| CATEGORII DOCUMENTE |
| Astronomie | Biofizica | Biologie | Botanica | Carti | Chimie | Copii |
| Educatie civica | Fabule ghicitori | Fizica | Gramatica | Joc | Literatura romana | Logica |
| Matematica | Poezii | Psihologie psihiatrie | Sociologie |
DEPLASAREA ECHILIBRULUI CHIMIC. PRINCIPIUL LUI LE CHATELIER
Conditiile care determina starea de echilibru chimic sunt: concentratia si temperatura, iar pentru sistemele chimice in stare gazoasa si presiunea. Echilibrul chimic poate fi influentat sau deplasat prin variatia unuia dintre acesti factori, sau a tuturor, simultan. Sensul in care se deplaseaza echilibrul chimic ca rezultat al acestor "constrangeri din afara urmeaza o lege cunoscuta sub numele de "principiul celei mai mici constrangeri sau "principiul echilibrului mobil formulat de catre Henry Le Chatelier (1885) si F. Braun (1886) astfel: cand asupra unui sistem chimic aflat in echilibru se exercita o constrangere din afara (concentratie, presiune, temperatura), atunci echilibrul se deplaseaza in sensul reactiei care se opune constrangerii, diminuand-o sau anuland-o.
Sa examinam pe rand prin exemple, influenta celor trei factori asupra reactiilor chimice reversibile aflate in echilibru.
1. Influenta temperaturii
Ridicarea temperaturii sistemelor de reactii aflate in echilibru provoaca o deplasare de la stanga la dreapta in cele mai multe reactii printre care:
![]() 2H2O 2H2 + O2
2H2O 2H2 + O2
![]() I2 2I-
I2 2I-
![]() 2HI H2 + I2
2HI H2 + I2
avand loc formarea compusilor care consuma caldura (reactii endoterme). Prin coborarea temperaturii se favorizeaza reactiile exoterme care au loc cu degajare de caldura.
2. Influenta presiunii
In sinteza amoniacului din elemente reactia este exoterma si are loc cu micsorare de volum, deci de presiune.
![]() N2
+ 3H2 2NH3
N2
+ 3H2 2NH3
De aceea, reactia nu poate fi efectuata la temperaturi prea inalte (peste 500oC) deoarece are loc formarea produsilor endotermi rezultati prin descompunerea NH3. De asemenea, reactia decurgand cu scadere de presiune, putem favoriza reactia de sinteza a amoniacului marind presiunea. Aceste conditii de temperatura si presiune fac sa se lucreze curent intre 3000-1000 atm si la o temperatura de circa 500oC in prezenta catalizatorilor (la temperaturi mai scazute azotul prezinta inertie chimica).
Aplicand legea actiunii maselor se obtine:
 respectiv
respectiv
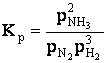
unde Kc reprezinta
3. Influenta concentratiei
Reactia reversibila de obtinere a Fe(SCN)3 (substanta de culoare rosu-sange) este utilizata la identificarea ionului feric:
![]() FeCl3
+ 3KSCN Fe(SCN)3
+ 3KCl
FeCl3
+ 3KSCN Fe(SCN)3
+ 3KCl
si are urmatoarea
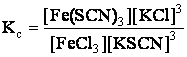
Daca se adauga reactanti, de exemplu KSCN, creste concentratia in produsi prin deplasarea echilibrului spre dreapta, cu intensificarea culorii rosii, datorita formarii combinatiei Fe(SCN)3. Aceasta rezulta si din expresia matematica anterioara deoarece, crescand numitorul (concentratia KSCN), va trebui sa creasca si numaratorul (concentratia Fe(SCN)3) pentru ca valoarea constantei de echilibru sa nu se modifice. Daca se adauga KCl, deci un produs de reactie, echilibrul se deplaseaza catre stanga cu formare de reactanti, reactia decurgand cu diminuarea culorii rosii, pana la decolorarea totala, datorita descompunerii colorantului Fe(SCN)3.
|
Politica de confidentialitate | Termeni si conditii de utilizare |

Vizualizari: 7491
Importanta: ![]()
Termeni si conditii de utilizare | Contact
© SCRIGROUP 2026 . All rights reserved