| CATEGORII DOCUMENTE |
| Astronomie | Biofizica | Biologie | Botanica | Carti | Chimie | Copii |
| Educatie civica | Fabule ghicitori | Fizica | Gramatica | Joc | Literatura romana | Logica |
| Matematica | Poezii | Psihologie psihiatrie | Sociologie |
METODE DE OBTINERE A SISTEMELOR COLOIDALE
Sistemele microeterogene si ultramicroeterogene sunt intermediare din punctul de vedere al gradului de dispersie intre dispersiile eterogene si cele moleculare. Sistemele coloidale de tipul solurilor, aerosolurilor, suspensiilor se formeaza prin doua tipuri de metode:
a) prin dispersarea (fragmentarea) particulelor grosiere in particule mai mici pana se ajunge in domeniul dimensiunilor coloidale;
b) prin condensarea (aglomerarea) moleculelor sau ionilor dintr-o solutie in particule coloidale.
1. Dispersarea
Fragmentarea unei substante compacte solide aflata intr-un mediu de dispersie lichid duce la inceput, la formarea unor particule relativ mari, grosiere (suspensii, emulsii, spume). Daca maruntirea continua, se obtine in final un sistem cu particule fine cu dimensiunea cuprinsa intre 10-5 - 10-7 cm (sol). Trecerea de la sistemul macroeterogen la cel microeterogen si apoi ultramicroeterogen se produce printr-o succesiune de sisteme intermediare, cu grade de dispersie tot mai ridicate.
Dispersarea fazei disperse are loc prin cresterea suprafetei de separare dintre aceasta si mediul de dispersie, respectiv prin cresterea entalpiei libere interfazice. Energia cheltuita la dispersarea substantei solide va fi cu atat mai ridicata cu cat este mai mare tensiunea superficiala. In prezenta substantelor tensioactive, tensiunea superficiala a sistemului scade si dispersarea se realizeaza mai usor (efect Rehbinder). Particulele care rezulta prin dispersarea solidelor in prezenta substantelor superficial-active vor avea la suprafata lor straturi de adsorbtie (filme) protectoare care maresc stabilitatea sistemelor obtinute. Dispersarea in prezenta substantelor tensioactive intervine in domenii cum ar fi: dispersarea unor materiale ca gipsul, grafitul, diferiti coloranti, macinarea minereurilor inainte de concentrarea lor.
Metodele de dispersare sunt inferioare celor de condensare din punctul de vedere al gradului de dispersie al sistemului obtinut. Sistemele ale caror particule au dimensiuni sub 1 m se obtin rar prin dispersare.
Dispersarea se poate realiza prin diferite metode.
1.1. Dispersarea mecanica
Substanta solida este fragmentata cu ajutorul unor dispozitive numite mori coloidale (Plausson, 1920). Ele actioneaza pe principiul combinarii fortei centrifuge cu forta de frecare, forfecare, lovire sau vibratorie, in functie de natura dispozitivului. Sunt cunoscute si mori cu jet care functioneaza pe principiul turbionar.
Dispersarea mecanica a fost aplicata prima data in laborator de catre Weimarn (1910) pentru a obtine in stare coloidala : S, Hg, Se, Au, Ag, Al(OH)3, BaSO4, si BaSO3. Weimarn a adaugat la macinare diferite adaosuri cristaline, in special zahar si dizolvanti.
Dispersarea substantelor se poate executa si in stare uscata cand se urmareste obtinerea unor pulberi in mori centrifuge cu bile.
Dispersarea mecanica este folosita in industria alimentara si chimico-farmaceutica la obtinerea suspensiilor si a pulberilor, in agrotehnica la prepararea dispersiilor insecticide, fungicide si de ingrasaminte chimice, in industria colorantilor si a vopselelor la fabricarea cernelurilor, tusurilor si a suspensiilor de pigmenti minerali sau organici in ulei. De asemenea, metoda este folosita in industria extractiva a petrolului la obtinerea suspensiilor de namol pentru foraje, in industria constructiilor la prepararea liantilor de constructie si in industria celulozei si a hartiei.
1.2. Dispersarea cu ultrasunete
Daca substanta solida se introduce intr-un camp ultrasonor, ea se faramiteaza datorita vibratiilor. Dispersarea prin ultrasunete a fost aplicata pentru prima data de catre Wood si Loomis in 1927 la prepararea emulsiilor de mercur in apa.
In dispersarea ultrasonica se folosesc generatori de cuart sau de titanat de bariu piezoelectric. Domeniul de frecventa utilizat la dispersare este larg, fiind cuprins intre 0,1 si 40 MHz. Cele mai utilizate frecvente sunt intre 0,3 - 1 MHz. Prin aceasta metoda se pot obtine sisteme disperse stabile, cu particule fine (soluri) de oxizi ai metalelor, sulf, grafit, pigmenti in diferite medii de dispersie cum sunt: apa, parafina, colodiul.
Amplitudinile vibratiilor ultrasonore au acelasi ordin de marime cu al dimensiunilor particulelor coloidale. Prin aceasta metoda s-au obtinut sub forma de sol: Pb, Bi, Cu, Ag.
Prin dispersarea cu ultrasunete care este mai economica decat macinarea sau dispersarea electrica, se obtin produsele cele mai uniforme, monodisperse, fiind aplicata la transformarea solurilor polidisperse in soluri monodisperse.
Undele ultrasonore pot provoca la frecvente relativ mici (103 Hz) efecte inverse dispersarii si anume procese de coagulare a particulelor coloidale (Rastogi, Srivstava, 1969).
Metoda se aplica la dispersarea unor compusi cum sunt: gelatina, amidonul, guma arabica care sufera si reactii chimice de degradare sau denaturare.
Ultrasunetele s-au folosit la separarea celor mai diferite soluri si a diferitelor emulsii si suspensii de hidroxizi metalici, albumine, coloranti, uleiuri. De asemenea, s-au obtinut aliaje de metale nemiscibile cum sunt Al si Pb, emulsii fotografice din halogenuri de argint.
1.3. Dispersarea electrica
Aceasta metoda ocupa un loc deosebit intre metodele de dispersare si cele de condensare.
Metoda Bredig (1898) consta in trecerea unui curent electric continuu prin doi electrozi formati din metalul care se disperseaza. Electrozii sub forma de fire sunt asezati sub apa (mediul de dispersie), iar intre ei apare arcul electric necesar dispersarii. Prin aceasta metoda, Bredig a preparat hidrosoluri de Au, Ag si Pt.
Mecanismul formarii solurilor prin metoda arcului electric este urmatorul: intr-o prima etapa, la temperatura ridicata a arcului electric, metalul electrozilor se vaporizeaza si se produce o pulverizare de metal topit sub forma unor particule grosiere. In etapa a doua, la temperatura mult mai mica a lichidului dispersant, vaporii metalici se condenseaza brusc, obtinandu-se particule coloidale. La formarea solului concura atat procesul de dispersare, adica vaporizarea si pulverizarea termica a metalului, cat si cel de condensare a vaporilor metalici.
Solurile obtinute contin in suspensie si particule grosiere rezultate prin pulverizarea termica. La temperatura ridicata a arcului electric, mediul de dispersie lichid se poate descompune si produsii descompunerii impurifica solul, impunandu-se racirea lichidului dispersant. Prin racire se intensifica suprasaturarea sistemului si vaporii metalici se condenseaza mai usor in particule coloidale.
Cand electrozii sunt introdusi intr-un mediu de dispersie organic, acesta se descompune la trecerea curentului electric, obtinandu-se un sol metalic impurificat cu carbon. Astfel metoda lui Bredig devine inaplicabila.
Svedberg (1906) aduce modificari metodei lui Bredig. Prima modificare consta in inlocuirea electrozilor, confectionati din metalul care se disperseaza cu electrozi de fier sau aluminiu si introducerea metalului care trebuie dispersat sub forma de granule la baza celulei de electroliza. Arcul electric unic al metodei Bredig este inlocuit cu o serie de arcuri mici care se produc intre granulele metalului dispersat.
A doua modificare importanta adusa de Svedberg este utilizarea curentului alternativ de frecventa ridicata in locul celui continuu. Prin aceasta metoda, Svedberg a preparat organosoluri ale metalelor alcaline in hidrocarburi. Gradul de dispersie al solurilor rezultate este mai ridicat decat prin metoda Bredig.
Intr-o alta varianta a metodei de dispersare electrica, Svedberg (1919) a efectuat dispersarea prin efect Joule al curentului electric care trece printr-un fir din metalul respectiv intins intre doi electrozi de fier. S-au obtinut alcoosoluri de Pt, Au, Ag, Sn, Cu Zn. Prepararea solurilor prin aceasta metoda se bazeaza pe condensarea vaporilor metalici formati prin incalzirea firului conductor sub actiunea curentului electric.
1.4. Dispersarea chimica. Peptizarea
Dispersarea substantelor poate avea loc uneori in mod spontan, fara aport de energie exterioara (mecanica, electrica) daca se face in prezenta unor adaosuri, de obicei electroliti. Astfel mercurul dispersat in apa pura nu formeaza niciodata un sol destul de stabil. Daca dispersarea se realizeaza intr-o solutie de Ca(NO3)2 2,5∙10-3 N, prin diluare se obtine un sol rosu stabil de mercur.
In acest caz, dispersarea nu mai este un proces fizic, ci un fenomen chimic coloidal, caracteristic tuturor coloizilor liofobi si liofili numit peptizare. Substanta in prezenta careia are loc peptizarea se numeste peptizator si are rol de stabilizator in procesul de peptizare.
Peptizatorii pot fi substante anorganice (acizi, baze, saruri) si organice.
Peptizarea nu trebuie confundata cu stabilizarea si protejarea care se exercita asupra sistemelor coloidale care au fost dispersate printr-un procedeu oarecare.
Peptizarea poate fi clasificata in patru tipuri principale dupa mecanismul de desfasurare:
a) Peptizare adsorbtiva
b) Peptizare disolutiva
c) Peptizare chimica
d) Peptizare coloidala
a) Peptizarea adsorbtiva are loc prin adsorbtia ionilor unui electrolit neutru sau a unui neelectrolit care nu reactioneaza cu substanta (insolubila) peptizata. Un exemplu il constituie peptizarea halogenurilor de argint cu solutii de halogenuri solubile (NaCl) sau peptizarea oxizilor metalici cu diferite saruri neutre. Cu solutii diluate de electroliti peptizeaza: globulina, seroproteinele, hormonii proteici, anticorpii (Nenitescu)
b) Peptizarea disolutiva consta in formarea unei combinatii solubile intre peptizator si o mica parte a fazei disperse, sub forma unui compus oarecare sau complex. Acest complex peptizeaza apoi intreaga cantitate de faza dispersa, avand rolul de peptizator. Peptizarea disolutiva poate avea loc numai cu precipitate proaspete ale caror particule nu au format conglomerate mai mari, cristaline.
c) Peptizarea chimica consta in prima faza, intr-o reactie chimica de precipitare, iar in faza a doua are loc peptizarea spontana a precipitatului rezultat cu substanta initiala ramasa in solutie sau cu partea solubila a precipitatului.
Ca exemplu este formarea solului de azotat bazic de bismut, reactie caracteristica in chimia analitica:
Bi(NO3)3 + H2O à BiONO3 + 2HNO3
d) Peptizarea coloidala se produce cu ajutorul coloizilor liofili de protectie sau al agentilor activi de suprafata. Exemplu: peptizarea cu detergenti in procesul de indepartare a impuritatilor la spalare.
Peptizarea prezinta importanta in chimia analitica unde acest fenomen trebuie luat in considerare la separarea cantitativa a precipitatelor. Peptizarea precipitatelor se evita prin adaugarea de electroliti la apa de spalare.
2. Condensarea
Condensarea conduce la sisteme coloidale cu grad de dispersie mare (105 - 107 cm-1), cum sunt solurile. Metodele de condensare presupun formarea unei solutii suprasaturate prin diverse tipuri de reactii chimice sau pe cale fizica. Din aceste solutii se separa faza dispersa sub forma de particule coloidale.
Weimarn (1910) a aratat ca procesul de formare a particulelor coloidale, respectiv a unei faze noi decurge in doua etape:
aparitia nucleelor de condensare a fazei noi, caracterizata prin viteza de nucleatie;
cresterea nucleelor prin cristalizare.
Aparitia nucleelor este cauzata de fluctuatiile de densitate care conduc la aglomerari intamplatoare de molecule.
In cazul particulelor solide, cresterea nucleelor reprezinta un proces de cristalizare pana la obtinerea dimensiunilor coloidale. Procesul este controlat de difuzia ionilor sau a moleculelor din solutia suprasaturata spre nucleele deja formate printr-un strat de difuzie aflat la suprafata particulelor.
Sistemele coloidale cu particule fine (soluri) se obtin cand viteza de nucleatie este mare in comparatie cu cea de crestere a cristalelor.
Daca viteza de crestere a nucleelor este mult mai mare decat viteza de nucleatie atunci apare un numar mic de nuclee care cresc rapid, ducand la formarea unor cristale ce se pot separa sub forma de precipitat.
Dimensiunea particulelor este in functie de concentratia reactantilor folositi la obtinerea sistemelor coloidale prin reactii chimice.
La amestecarea unor solutii diluate se obtine un sol deoarece cantitatea de substanta necesara cresterii cristalelor este redusa. La concentratii mai mari se obtin particule grosiere in suspensie care sedimenteaza, formand un precipitat.
Pentru o concentratie de suprasaturare data, gradul de dispersie este cu atat mai ridicat cu cat este mai mica solubilitatea substantei ce formeaza faza dispersa.
In procesele de formare a sistemelor coloidale, la suprafata particulelor apare stratul dublu electric. Complexul format din particula propriu-zisa si ionii din stratul dublu (Gouy si Stern) se numeste micela liofoba (Duclaux, 1908).
Metodele de condensare folosite pentru obtinerea sistemelor coloidale se impart in metode chimice si metode fizice.
2.1. Metode chimice
Metodele chimice prin care se obtin soluri liofobe de produsi insolubili se bazeaza pe:
a) Reactii de dublu schimb
b) Reactii de hidroliza
c) Reactii de oxido-reducere
d) Condensare chimica in prezenta coloizilor de protectie
a) Reactii de dublu schimb
Se obtin solurile halogenurilor de argint, hidroxizilor, ferocianurilor metalelor grele, acizilor in mediu de dispersie apos.
Solurile halogenurilor de argint:
KX + AgNO3 à AgX + KNO3
unde: X = Cl, Br, I
sunt stabili, avand particule fine care nu se depun daca se formeaza in prezenta unui mic exces din reactivii utilizati.
Drept exemplu se va discuta cazul particulelor de AgI. Daca AgNO3 este in exces, se observa in camp electric (la electroforeza) ca particulele solului AgI se indreapta spre catod, fiind incarcate pozitiv.
In prezenta unui exces de KI, particulele solului AgI se incarca negativ, indreptandu-se spre anod.
Pentru a explica sarcina particulelor coloidale, se admite ca la suprafata acestora se adsorb ionii excesului de reactiv ceea ce duce la formarea stratului dublu electric.
Conform regulii Fujans - Dumanski se adsorb preferential ionii din excesul de reactiv care sunt comuni cu nucleul particulei coloidale.
Pentru exemplificare se presupune ca reactivul in exces este KI. La suprafata particulelor coloidale constituite prin condensarea a m molecule de AgI, se adsorb n ioni I-, iar un anumit numar de (n-x) contraioni K+ adera la cei n ioni I-, formand impreuna un strat compact de grosime (de tip Stern). Pentru a fi respectata conditia de neutralitate, alti x ioni K+ dau nastere stratului difuz de grosime d (de tip Gouy). Intregul sistem format din particula propriu-zisa si ionii din stratul dublu electric constituie o micela (fig. 4.6.) care poate fi redata schematic, astfel:
[mAgI∙nI- (n-x)K+]x- xK+
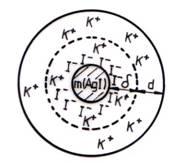
Fig. 4.6. Schema unei micele
Complexul ce intra in paranteza mare a micelei este format din nucleul de AgI si ionii din stratul compact si reprezinta particula incarcata cu x sarcini negative. In mediul de dispersie se gasesc cei x ioni K+ din stratul difuz.
Daca solul de AgI se obtine in prezenta unui exces de AgNO3 atunci ionii Ag+ se vor adsorbi la suprafata particulelor.
Schema micelei este:
[mAgI∙nAg+ (n-x)NO3-]x+ xNO3-
De obicei m>> n.
Iordis (1902) a semnalat ca din punct de vedere al compozitiei chimice, particulele coloidale nu corespund exact compusului care ar trebui sa se formeze prin reactia chimica. Particulele contin ca impuritate reactantii din care au fost obtinute.
Deci, sistemul coloidal este stabil daca se lucreaza in prezenta unui reactiv in exces.
Alte reactii de dublu schimb prin care se formeaza soli (sulfuri, acid salicilic) sunt:
2H3AsO3 + 3H2S à As2S3 + 6H2O
Na2SiO3 + 2HCl à H2SiO3 + 2NaCl
b) Reactii de hidroliza
Se pot prepara soluri liofobe atunci cand acizii sau bazele slabe rezultate prin hidroliza sarurilor acestora sunt insolubile. Sarurile cele mai folosite pentru obtinerea solurilor liofobe prin hidroliza sunt nitritii, acetatii si mai rar clorurile.
Solurile de Fe(OH)3 si H2SiO3 se formeaza prin urmatoarele reactii de hidroliza:
FeCl3 + 3H2O ![]() Fe(OH)3 + 3HCl
Fe(OH)3 + 3HCl
Na2SiO3 + 2H2O
![]() H2SiO3 + 2NaOH
H2SiO3 + 2NaOH
Analiza solului de hidroxid feric a sugerat urmatoarea structura a micelei:
[mFeO(OH)∙nFeO+ (n-x)Cl-]x+ xCl-
Pentru a explica structura stratului dublu electric de la suprafata, Pauli a presupus ca moleculele superficiale ale particulei coloidale reactioneaza cu acidul rezultat prin hidroliza, formand oxiclorura de fier care ionizeaza:
FeO(OH) + HCl à FeOCl + H2O
FeOCl à FeO+ + Cl-
Goldztaub a aratat ca oxiclorura de fier se formeaza prin hidroliza FeCl3 care are loc in trepte:
FeCl3 + H2O à FeOCl + 2HCl
FeOCl + H2O à FeO(OH) + HCl
Pe baza acestui mecanism se considera nucleul particulei format dintr-un amestec de FeO(OH) si FeOCl in care predomina oxiclorura de fier, deoarece prima treapta a hidrolizei este mai accentuata. Deci micela solului de hidroxid feric poate fi redata schematic, astfel:
[(mFeO(OH) + pFeOCl)∙nFeO+ (n-x)Cl-]x+ xCl-
unde: p > m.
c) Reactii de oxido-reducere
Se aplica la prepararea solurilor de S, Au si a metalelor grele.
Solul de sulf se formeaza prin reactia de oxidare a hidrogenului sulfurat cand in solutia apoasa exista cromati, clorati sau alti ioni oxidanti:
H2S
+ ![]() O2
à S + H2O
O2
à S + H2O
Acest sol se poate obtine si din reactia tiosulfatului de sodiu cu acid sulfuric:
Na2S2O3 + H2SO4 à Na2SO4 + SO2 + H2O +S
Solul de sulf contine acizi politionici.
Solurile de aur se obtin prin reactiile de reducere a sarurilor corespunzatoare, utilizand ca reducatori: P, CH2O, NH2OH, tanin, hidrochinona, acid citric, CO:
2AuCl3 + 3CH2O + 3H2O à 2Au + 3HCOOH + 6HCl
Un reducator cunoscut cu ajutorul caruia se obtine "purpura lui Causius" este SnCl2, conform reactiei:
2HAuCl4 + 3SnCl2 à 3SnCl4 + 2HCl + 2Au
In mod analog se obtin purpurele de Ag, Pt. La prepararea purpurelor se adauga si stabilizatori sau protectori.
Sarurile metalice se pot reduce si cu ajutorul curentului electric. In acest caz nu se obtin solurile metalelor, ci solurile combinatiilor lor cu apa si cu celelalte substante din solutie. De exemplu, solul de Ag2O se obtine prin electroliza AgNO3 cu electrozi de platina.
O clasa de reactii de oxido-reducere care dau produsi coloidali monodispersi sunt reactiile in flacara, cum este reactia de obtinere a negrului de fum din metan, aplicata in industrie.
Prin ardere in flacara a clorurilor se pot obtine pulberi fine monodisperse de ZnO, SiO2 si TiO2.
d) Condensare chimica in prezenta coloizilor de protectie
Solutiile coloizilor liofili au asupra solurilor liofobe o actiune stabilizatoare care permite prepararea solurilor liofobe de concentratie mai mare. Actiunea stabilizatoare a acestor soluri liofile se numeste protejare coloidala, iar solurile respective, coloizi de protectie.
Principalii coloizi de protectie care prezinta importanta sunt: gelatina, gluten, amidon, guma arabica, acizi humici, produsi de hidroliza alcalina a albuminei (ovalbumina, lactalbumina). Pe langa acesti coloizi de protectie propriu-zisi, se utilizeaza ca protectori si unele produse vascoase care maresc stabilitatea prin marirea vascozitatii solurilor, ca de exemplu: lanolina, glicerina, zahar.
Cele mai cunoscute exemple de soluri liofobe protejate sunt solurile metalelor nobile si platinice utilizate in biologie si in cataliza, solurile halogenurilor de argint utilizate in fotografie.
2.2. Metode fizice
Metodele fizice se folosesc la prepararea organosolurilor metalici. Dezavantajul metodelor fizice consta in faptul ca avand loc in absenta substantelor chimice straine, solurile obtinute sunt instabile si trebuie stabilizate ulterior, operatie care reuseste mai greu decat condensarea chimica in prezenta coloizilor de protectie.
Dintre metodele de condensare fizica, cele mai cunoscute sunt:
a) metoda inlocuirii solventului (dizolvantului, mediului de dispersie)
b) metoda condensarii concomitente a fazei disperse si a mediului de dispersie
a) In metoda inlocuirii mediului de dispersie, substanta care va forma faza dispersa se solva initial intr-un solvent potrivit. Solutia formata se toarna apoi intr-un al lichid miscibil in orice proportie cu primul, dar care nu dizolva substanta data. Solutia suprasaturata care se formeaza in primul moment, se transforma imediat intr-un sol. Astfel, turnand lent o solutie alcoolica de colofoniu in apa, se obtine hidrosolul de colofoniu. Prin aceasta metoda Svedberg a preparat hidrosolul acidului palmitic, folosind solutia alcoolica a acestuia.
b) Metoda condensarii concomitente a fost realizata prima data de Semenov in colaborare cu Salnikov (1926) si perfectionata ulterior de Roginski (1927) si Tomasevski (1931).
Metoda consta in coevaporarea in acelasi recipient a metalelor impreuna cu lichidele organice in care se vor dispersa si condensarea pe un perete racit in exterior cu aer lichid.
Solurile de sodiu si potasiu in eter, preparati pe aceasta cale, sunt foarte stabile. Prin aceasta metoda se obtin organosoluri de Na, K, Hg si hidrosoluri de Cd, Hg, P, S.
|
Politica de confidentialitate | Termeni si conditii de utilizare |

Vizualizari: 7048
Importanta: ![]()
Termeni si conditii de utilizare | Contact
© SCRIGROUP 2026 . All rights reserved