| CATEGORII DOCUMENTE |
| Astronomie | Biofizica | Biologie | Botanica | Carti | Chimie | Copii |
| Educatie civica | Fabule ghicitori | Fizica | Gramatica | Joc | Literatura romana | Logica |
| Matematica | Poezii | Psihologie psihiatrie | Sociologie |
Proprietati specifice structurii cristaline
Substantele solide cu structura cristalina sunt formate din ioni, atomi sau molecule componente care se gasesc intr-o ordonare aproape perfecta in tipare geometrice regulate.Gradul inalt de ordonare al structurii cristaline este consecinta echilibrului dintre fortele de atractie si fortele de respingere care se manifesta intre aceste componente. Fortele de atractie sunt legaturile ionice, atomice, fortele van der Waals, puntile de hidrogen si legaturile metalice, iar fortele de respingere sunt de natura cuantica si se datoresc repulsiei dintre orbitalii atomilor, ionilorsau moleculelor care compun substanta cristalina.
Cristalele au forme geometrice poliedrice definite, marginite prin fete plane ce se intretaie in muchii, care la randul lor se intalnesc in colturi, forme care in majoritatea cazurilor sunt vizibile macroscopic. Elementele de simetrie ale cristalelor sunt: axele de simetrie, planele de simetrie si centrul simetric.
Axa de simetrie este directia in jururl careia rotind cu 360 un cristal el se prezinta de n ori in pozitii cu cea de plecare. In functie de simetria lor formele cristaline cunoscute au fost grupate in 7 sisteme: cubic, patratic, rombic, monoclinic, triclinic, romboedric si hexagonal.
Planul de simetrie taie un cristal in doua jumatati, astfel ca fata de plan una dintre jumatati reprezinta imaginea in oglinda a celeilalte jumatati.
Centrul de simetrie este un punct din interiorul cristalului fata de care muchiile, colturile si fetele cristalului sunt simetrice.
S-a stabilit ca particulele care compun cristalele respectiv ionii, atomii sau moleculele sunt dispuse intr-o retea cristalina, ocupand nodurile retelei. Planele in care se gasesc nodurile poarta denumirea de plane reticulare. Distanta dintre doua plane reticulare o reprezinta constanta de retea. Pentru a caracteriza o retea cristalina este suficient sa se cunoasca numai o portiune mica din ea, numita celula elementara si care repetata formeaza intreaga retea.
In functie de natura particulelor aflate in nodurile retelei cristaline si de fortele care se exercita intre aceste particule se disting patru tipuri fundamentale de retele cristaline: reteaua ionica, reteaua atomica, reteaua moleculara si reteaua metalica.
Reteaua ionica este aceea in care in noduri sunt dispusi ioni pozitivi si negativi intre care se manifesta legaturi ionice ( electrovalente). Ex. De retele ionice: NaCl, AgBr, MgO, PbS.
Reteaua atomica este aceea in care in noduri sunt dispusi atomi uniti prin legaturi covalente. Legaturile covalente care se exercita in retea sunt orientate in spatiu si in majoritatea cazurilor se realizeaza prin hibridizarea orbitalilor. Retelele atomice pot fi si stratificate atunci cand sunt formate din straturi in care atomii sunt legati covalent, dar intre straturi exista legaturi mai slabe ca de ex. forte van der Waals sau legaturi de hidrogen.
Ex. de retele atomice: diamantul, siliciul si retelele stratificate ale atomilor- grafitul.
Reteaua moleculara este aceea in care in noduri sunt dispuse molecule nepolare sau polare, legaturile dintre aceste particule fiind de tip van der Waals sau de hidrogen. Ex. de retele moleculare: hidrocarburile, F, Br, I, P. Caracteristici: duritate mica, p.t. si p. F. Joase, conductibilitate electrica slaba, solubilitate ridicata in solventi neaposi.
Reteaua metalica este specifica metalelor. In nodurile unei retele metalice se gasesc fie cationi metalici fie atomi neutri. In spatiile dintre nodurile retelei exista electroni care pot circula prin benzile de conductie ale cristalului. Functie de densitatea electronica cationul din reteaua metalica poate deveni atom neutru si invers. Intre atomii metalici se stabileste asa numita legaura metalica, ce determina formarea unor structuri foarte stabile, compacte. In cazul metalelor se cunosc trei tipuri de retele: retele cubice centrate pe fete, retele cubice centrate intern si retele hexagonale compacte. Structura cristalina a metalelor influenteaza proprietatile lor.
Aceasta legatura confera proprietati specifice metalelor cum ar fi: conductibilitate mare electrica si termica, luciu metalic, opacitate, rezistenta mecanica mare, maleabilitate, ductilitate, capacitate de cristalizare, etc. Se manifesta în stare solida si lichida, dar dispare în stare de vapori.Astfel metalele prezinta o buna conductibilitate termica si electrica, sunt maleabile, ductile, prezinta rezistenta la intindere, au luciu metalic, pot forma aliaje cu usurinta.
Metalele se deosebesc de celelalte elemente printr-o serie de proprietati comune, iar intre ele se diferentiaza in functie de proprietatile lor specifice, evidentiate prin pozitia acestora in sistemul periodic al elementelor. Legaturile existente in metale sunt de un tip special. Tinand seama de caracterul electropozitiv al elementelor metalice nu se poate admite formarea legaturilor ionice intre atomii de acelasi fel. Nu este posibila nici formarea unor legaturi covalente, deoarece in structura unui cristal metalic, fiecare atom are 8 sau 12 atomi vecini mai apropiati. Numarul lor este mult prea mare pentru a se putea lega prin legaturi covalente normale. De asemenea, fortele de legatura in metale sunt mult prea mari pentru a fi atribuite fortelor van der Waals. Ramane deci existenta unei noi forme de legatura si anume legatura metalica. Pentru explicarea acestei legaturi au fost eleborate mai multe teorii si anume:
1. Teoria gazului de electroni a fost emisa de Drude (1900) care considera ca electronii periferici se comporta ca un gaz de electroni avand o miscare dezordonata ca si moleculele de gaz. Gazul de electroni difuzeaza prin reteaua cristalina a metalului ale carui noduri sunt formate din resturile de atomi, respectiv din ioni pozitivi. Interactiunea dintre ionii pozitivi si gazul electronic ar constitui legatura metalica. Fortele de legatura se manifesta in toate directiile, deci legatura nu este dirijata. Aceasta teorie a permis explicarea calitativa a unor proprietati caracteristice metalelor. Astfel prezenta ionilor pozitivi in cristalul metalic determina densitatea, duritatea, tenacitatea, reactivitatea iar prezenta electronilor liberi determina luciul, opacitatea, conductibilitatea termica si electrica. Electronii mobili nu parasesc reteaua metalica datorita barierei de potential care inconjoara aceasta retea si care respinge electronii ajunsi la suprafata metalului compact. Ei pot parasi insa metalul cand se aplica un potential mare. Asa se explica formarea razelor catodice.
2. Teoria legaturii de valenta a fost dezvoltata de Pauling si are la baza ideea formarii legaturii prin perechi de electroni. Perechile de electroni care leaga atomii unui metal se pot deplasa in toate directiile pe care se afla nucleele atomice. Deci, libertatea de miscare a electronilor este limitata la directiile pe care se afla atomii metalului in cristal si anume 4 directii si 8 sensuri pentru structura afanata si 6 directii si 12 sensuri pentru structuri compacte.
Tinand cont ca in reteaua cristalina a metalelor fiecare atom este inconjurat in imediata vecinatate de un numar mai mare de atomi decat numarul de electroni de valenta, Pauling considera ca legatura metalica este o covalenta delocalizata. Astfel intr-un metal alacalin fiecare atom poate realiza o singura pereche de electroni care se dispenseaza intre cei 8 vecini apropiati. In consecinta legatura va fi slaba, fiecarei perechi de atomi revenindu-i 1/8 dintr-o legatura intreaga. De aceea metalele alcaline sunt moi, au densitate mica si p.t. scazut. Pe masura ce numarul perechilor de electroni, deci al legaturilor este mai mare, cresc si anumite proprietati ale metalelor precum densitatea, duritatea, p.t., p. F.. Paralel cu taria legaturilor cresc si proprietatile fizico- mecanice.
3. Teoria orbitalilor moleculari
A. Sommerfeld, E. Fermi si altii au interpretat (dupoa 1927) formarea legaturii metalice prin teoria orbitalilor moleculari. Dupa conceptia lor exista o diferenta între distributia electronilor într-un atom izolat al uni metal si distributia electronilor în cristalul de metal. Atomii izolati ai unui metal între care nu se produc interactiuni, au nivele energetice distincte iar ocuparea lor cu electroni se face în ordinea crescatoare a energiilor lor, respectând regulile lui Hund si principiul excluziunii al lui Pauli. In metalul compact, atomii sunt apropiati între ei, astfel încât nivelele lor energetice exterioare se pot combina dând orbitali moleculari. Se stie ca numarul orbitalilor moleculari este egal cu numarul orbitalilor atomici din care au provenit. La un numar foarte mare de atomi apropiati, cazul metalului compact, rezulta un numar tot asa de mare de orbitali moleculari delocalizati care se contopesc în benzi de energie. Astfel din N orbitali atomici rezulta N orbitali moleculari delocalizati. Dintr-un numar de N orbitali moleculari, N 2 vor fi orbitali moleculari de legatura de energie mai joasa si N 2 vor constitui banda orbitalilor moleculari de antilegatura de energie mai înalta.
Latimea unei benzi de energie depinde de posibilitatea contopirii orbitalilor atomici, aceasta se produce invers proportional cu distanta de la nucleele atomice. Electronii nivelelor interioare apropiati de nucleele atomilor constituenti ai cristalului de metal au practic aceeasi energie ca cei din atomii izolati. Se impun deci doua conditii pentru formarea benzilor
Existenta unui numar foarte mare de atomi care participa la legatura
Nivelele de energie de valenta care se întrepatrund sa fie foarte apropiate.
La metalele din grupele principale, orbitalii atomici cei mai potriviti din punct de vedere energetic pentru formarea orbitalilor moleculari sunt orbitali s si p iar pentru cele tranzitionale orbitalii d, s, p.
Pentru exemplificare se considera Sodiul atomul izolat de Na (Z 11) are urmatoarea configuratie electronica
1s12s22p63s13p0
Orbitalii interiori 2s22p6 nu participa la formarea legaturilor. Orbitalii 3s si 3p fiind apropiati energetic vor forma banda de energie.
N atomi de sodiu ai unui cristal dispun de 4N orbitali atomici pentru delocalizare, 1 orbital 3s si 3 orbitali 3p de la fiecare atom din care rezulta 4N orbitali moleculari constituind banda de energie a orbitalilor moleculari de legatura si antilegatura.
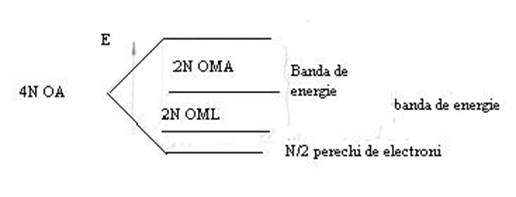
Din cei 4 orbitali atomici, numai orbitalul 3s este ocupat cu un singur electron. Deci N atomi vor avea N electroni de valenta, respectiv N 2 perechi de electroni care ocupa numai 1 4 din cei 2N orbitali moleculari de legatura respectiv din banda de valenta. Restul de 3 4 din banda de valentaconstituie portiunea de conductibilitate sau banda de conductie.
La aplicarea unui câmp exterior, electronii trec usor din portiunea ocupata în banda de conductie neocupata, determinând conductibilitatea metalului. Pe masura ce valenta metalului creste, portiunea ocupata din banda de legatura va fi mai mare. Aceasta imprima metalului duritate si refractaritate.
Metalele hexavalente Cr, Mo, W au întreaga banda a orbitalilor moleculari de legatura completata cu electroni. Aceste metale sunt cele mai dure si refractare, deoarece atomii lor realizeaza între ei un nor electronic de densitate maxima ceea ce îi apropie la distante minime. Conductibilitatea la aceste metale se realizeaza în banda orbitalilor moleculari de antilegatura.
Interpretarea proprietatilor metalelor prin teoria orbitalilor moleculari conduce la urmatoarele concluzii
- Conductibilitatea electrica cea mai mare o au metalele cu banda de valenta ocupata în proportie mica, în aceasta categorie intra metalele alcaline, Cu, Ag, Au
Metale lecare au orbitalul s de valenta complet ocupat cu electroni ca de exemplu metalele din grupele IIA si IIB vor avea banda de valenta ocupata în proportie mai mare, ceea ce determina o conductibilitate mai mica si proprietati fizico-mecanice mai ridicate.
- Cu cât valenta metalului va fi mai mare cu atât se va ocupa în proportie mai mare banda de valenta si în consecinta densitatea norului de electroni între atomi va fi mai mare, legatura între atomi mai puternica, iar proprietatile fizico+mecanice mai crescute.
|
Politica de confidentialitate | Termeni si conditii de utilizare |

Vizualizari: 754
Importanta: ![]()
Termeni si conditii de utilizare | Contact
© SCRIGROUP 2025 . All rights reserved