| CATEGORII DOCUMENTE |
| Astronomie | Biofizica | Biologie | Botanica | Carti | Chimie | Copii |
| Educatie civica | Fabule ghicitori | Fizica | Gramatica | Joc | Literatura romana | Logica |
| Matematica | Poezii | Psihologie psihiatrie | Sociologie |
Teoria atomo- moleculara
1. Introducere
Stiinta moderna recunoaste existenta a peste 18 milioane de substante compuse. Toate acestea sunt constituite din particule materiale simple, care se definesc drept elemente, entitati care nu mai pot fi descompuse in altele mai simple. Numarul acestor entitati este relativ mic, dar posibilitatile lor de combinare determina numarul mare de substante cunoscute; totusi daca luam in considerare substantele pure, denumite si compusi, acestea se vor descompune intotdeauna in aceleasi elemente. Exemplele sunt la indemana la fiecare pas; de exemplu hidrogenul si oxigenul gazos nu pot fi descompuse in alte substante, in schimb apa poate fi descompusa in cele doua elemente constitutive, hidrogenul si oxigenul.
O caracteristica importanta a acestor elemente este ca ele nu pot convertite prin mijloace chimice obisnuite in alte elemente, respectiv ele nu sunt transmutabile.
Legea nr. 1: LEGEA CONSERVARII MASEI
Legea care guverneaza toate schimburile de elemente este cunoscuta drept Legea conservarii masei: totalul masei reactantilor este egal cu totalul masei produsilor
Sa presupunem ca trebuie sa demonstram valabilitatea acestei legi.
In fapt aceste afirmatii sunt sustinute de numeroase observatii, care au necesit o mare cantitate de experimente dar mai ales o teribila gandire creativa pentru sistematizarea informatiilor din experimente. Pornind de la continutul ei putem sa deschidem portile experimentelor care ne conduc la teoria atomo-moleculara:
Afirmatiile anterioare, considerate corecte, sunt mult mai vagi in continut decat au parut la inceput. De exemplu, ce intelegeti atunci cand afirmati ca toate materialele sunt alcatuite din elemente? Cum adica un element nu poate fi descompus? Ce inseamna de fapt a combina elementele in compusi? Dorim sa intelegem mai multe despre natura elementelor si compusilor
astfel incat sa putem descrie elementele sunt combinate pentru a forma compusi, de ce compusii se pot descompune in elemente, dar mai ales de ce compusii sunt convertiti in alti compusi in timpul reactiilor chimice.
O posibilitate de a raspunde la aceste intrebari este sa presupunem ca un compus este format la simpla amestecarea a elementelor indestructibile, ca de exemplu nisip cu zahar! Nici nisipul, nici zaharul nu sunt descompusi in proces, iar amestecul poate fi foarte simplu descompus din nou in componentii originali. In acest caz, cu toate ca amestecul prezinta proprietatile ambelor componente, adica gustul dulce dat de zahar, dar si senzatia tipica data de "gustatul" nisipului.
In contrast cu acestea, compusul denumit rugina fierului are foarte putine asemanari cu fierul elementar, deoarece nu prezinta culoarea fierului elementar, nici densitatea, consistenta, magnetismul, etc. Deoarece noul compus nu mai are proprietatile compusilor initiali inseamna ca el nu este un amestec simplu al acestora.
Desigur am putea sarii direct la raspunsurile acestor intrebari prin a accepta ca elementele sunt compuse din atomi: indivizibili, particule identice in cazul aceluiasi element. Atunci un compus este format prin combinarea acestor atomi. Desigur, legea conservarii masei poate atunci fi usor explicata prin existenta acestor atomi "nedestructibili" de masa fixa. Totusi daca am sarii la aceste concluzii si am admite existenta atomilor fara alte certitudini (asa cum au acceptat chimistii secolelor XVII si XVIII) nu vom ajunge la nici un rezultat. Ce se intamplat cu fierul dupa incalzirea prelungita in aer? De ce combinatia fierului cu aerul nu mentine proprietatile celor doua substante initiale la amestecarea lor. O imagine atomica a naturii nu ne ofera inca posibilitatea intelegerii modului in care aerul a reactionat cu fierul pentru formarea noului compus, la fel nu putem anticipa ce cantitate de rugina rezulta dintr-o anumita cantitate de fier. Nu avem inca nici informatie privind proprietatile acestor atomi. Este deci nevoie de alte observatii!
Observatia 1. Relatia maselor in decursul reactiilor chimice.
Legea conservarii masei, prin ea insasi nu pretinde nici macar o conceptie atomica asupra elementelor. Masa poate fi conservata chiar daca materia nu are constitutie atomica! Importanta legii conservarii masei rezida din faptul ca putem masura maselor elementelor care sunt continute intr-o anumita masa a unui compus. Spre exemplu, la descompunerea carbonatului de cupru in elementele constitutive, cupru, oxigen si carbon, cantarind acestea si stabilind raportul de masa a cestora. Orice proba din acest compus va da ca rezultat 51,5% cupru, 38,8% oxigen si 9,7% carbon. Exprimat in alt mod raportul de masa a celor trei elemente se poate exprima 5,3 : 4 : 1, pentru orice masuratoare al oricarei probe de carbonat de cupru. Similar, in cazul sulfitului de plumb, procentual vom avea 86,7% plumb, 13,3% sulf, respectiv raportul de combinare fiind intotdeauna 6,5:1. Orice probe din aceste doua combinatii vor duce intotdeauna la aceleasi proportii de combinare, indiferent de cantitatea de proba luata in lucru!
Concluzia acestor exemple ne conduce la ceea ce se cunoaste drept Legea proportiilor finite.
Legea nr. 2: LEGEA PROPORTIILOR FINITE
Cand doua sau mai multe elemente se combina pentru a forma un compus, masele lor se regasesc in acest nou compus in raporturi definite si fixe.
Deja suntem pe calea care poate demonstra natura atomica a materiei. Putem argumenta deja ca, in cazul sulfurii de plumb, un atom de plumb se combina cu un atom de sulf. Daca asta este adevarat, atunci este evident ca raportul maselor celor doua elemente este 6,5:1. Deci, teoria atomica pare sa reprezinta raspunsul asteptat privind la modul formarii acestui compus, sau in alte cuvinte s-a gasit raspunsul la intrebare in ce fel se combina doua elemente pentru a forma un compus. Ne putem chiar permite sa prezicem ce cantitate dintr-un anumit compus se va forma dintr-o anumita cantitate data a unui element. De exemplu 6,5 g Pb for forma exact 7,5 g Sulfit de Pb, 50 g Pb vor produce 57,7g PbS, etc.
Exista totusi o mica problema, care poate fi usor reprezentata in cazul unui compus tri-component, format din hidrogen, oxigen si azot.
Daca examinam cazul monoxidului de azot, proportia masica O:N este 8 : 7. Daca aceasta inseamna ca un atom de azot se combina cu un atom de oxigen, ne asteptam ca masa unui atom de oxigen sa fie 8/7=1,14 din masa atomului de azot.
Tabelul 1. Relatia maselor in compusii Hidrogenului, Azotului si Oxigenului
|
Compus |
Masa Totala |
Masa H |
Masa N |
Masa O |
Masa "relativa" a H |
Masa "relativa" a N |
Masa "relativa" a O |
|
Monoxid de azot (NO) | |||||||
|
Amoniac | |||||||
|
Apa |
In al doilea rand sa examinam cazul amoniacului, o combinatie a azotului cu hidrogenul in proportie de masa N:H de 7:1,5. Rezulta deci ca daca un atom de azot se combina cu un atom de hidrogen masa azotului este de 4,67 ori masa atomului de hidrogen.
Din cele afirmate anterior putem face o conexiune intre masa atomului de oxigen si masa atomului de hidrogen. Daca masa atomului de oxigen este de 1,14 ori masa atomului de azot si masa atomului de azot este de 4,67 ori masa atomului de hidrogen, rezulta ca masa atomului de oxigen este de 1,14 4,67 = 5,34 ori mai mare ca masa atomului de hidrogen.
Ceva pare in neregula pentru aceste calcule, dar ce? Daca luam in considerare al treilea rand al tabelului 1, vom observa ca in cazul apei, obtinuta prin combinarea hidrogenului cu oxigenul, raportul masic O:H este de 8:1, sau cu alte cuvinte, masa atomului de oxigen este de 8 ori mai mare decat masa atomului de hidrogen. In consecinta, cele trei determinari ale relatiei masei pentru, hidrogen, azot si oxigen ne conduc la rezultate contradictorii.
Cum putem impaca aceste rezultate contradictorii. O prima posibilitate este de a lua in considerare modul diferit in care atomii diferitelor elemente pot forma compusi diversi. Daca este asa, este usor de inteles variabilitatea maselor care se combina. O a doua posibilitate o constituie ca am gresit probabil. Daca ne uitam inapoi v-om observa ca am presupus cati atomi din fiecare specie intra in combinatie, pentru a determina mai usor raportul de combinare. In toate exemplele studiate am presupus am presupus un raport 1:1 a fiecarui compus: Daca tinem cont ca este vorba de atomi ai diferitelor elemente, atunci acele stipulatii initiale sunt gresite, deoarece ofera mase atomice relative care difera de la compus la compus.
Cum putem gasii raspunsul corect privind raporturile atomice? Ar fi important de stiut nu doar raportul maselor atomice (de exemplu cel O:H este 8:1) dar mai ales formula chimica a compusului (adica numarul de atomi ai fiecarei specii prezente in compus), dar pentru a cunoaste formula trebuie sa cunoastem masa.
Raspunsul privind care din aceste doua posibilitati trebuie urmata pentru aflarea adevarul, trebuie sa continuam sa incercam sa analizam situatia prin alte observatii.
Observatia 2. Raporturi multiple ale maselor.
O importanta deosebita pentru lamurirea situatiei enuntata anterior este studierea situatiei unor compusi diferiti care contin acelasi element. De exemplu exista la ora actuala trei tipuri de oxizi ai azotului, compusi doar din atomi de azot si atomi de oxigen, pe care ii vom nota in continuare oxidul A, oxidul B si oxidul C. Raportul masic O : N pentru oxidul este 2,28 : 1; pentru oxidul B 1,14 : 1, iar pentru oxidul C, 0,57 : 1. Aceste raporturi ne conduc la concluzii contradictorii Legii proportiilor finite. Oricum, fiecare combinatie de mase dau de fapt un compus chimic unic care se diferentiaza de celelalte prin comportament chimic specific. De exemplu oxidul A este foarte toxic, in timp ce oxidul C este utilizat in anestezia umana. Este de asemenea adevarat ca raportul maselor nu este arbitrar, nu putem lua orice combinatie a maselor pentru combinarea azotului si oxigenului, ci suntem obligati sa consideram una din cele trei combinatii prezentate. Deci nu exista contradictie: suntem pur si simplu obligati sa respectam Legea proportiilor finite pentru a spune ca fie care produs este caracterizat printr-o raport masic bine definit al elementelor componente.
Noile raporturi masice prezinta aceiasi prima ipoteza ca raportul masic O : N este 1, si avem urmatoarele relatii simple:
2,28 : 1,14 : 0,57 = 2 : 1 : 0,5 (1)
= 4 : 2 : 1
Aparitia numerelor intregi, simple, in relatia de mai sus este extrem de importanta, deoarece prezinta extrem de simplu faptul ca compusul respectiv contine un multiplu fix de unitati de masa ale oxigenului. Tot acum putem afirma ca compusul B contine dublu numarului de atomi de oxigen iar compusul C doar jumatate din numarul atomilor de azot, comparativ cu compusul (oxidul) A. Concluzia privind structura acestor compusi poate fi usor derivata, fiind prezentata in Tabelul 2.
Formule moleculare posibile ale oxizilor de azot
|
Presupunand ca |
Oxidul C este NO |
Oxidul B este NO |
Oxidul A este NO |
|
Oxidul A este |
NO4 |
NO2 |
NO |
|
Oxidul B este |
NO2 |
NO |
N2O |
|
Oxidul C este |
NO |
N2O |
N4O |
Din date prezentate pana acum nu putem afirma care din aceste formule corespund in mod real compusilor respectivi.
Legea 3: Legea proportiilor multiple
Atunci cand doua elemente se combina pentru a forma mai multi compusi, masa elementului A care se combina cu o anumita cantitate din compusul B este reprezentata printr-un numar intreg al raportului masic al aceluiasi element A in alta combinatie cu elementul B
Desi pare confuza, aceasta poate fi simplu clarificata prin exemplul urmator: sa consideram carbonul fiind elementul B iar oxigenul elementul A, respectiv cazul oxizilor carbonului. Sa luam o masa fixa de element B (carbon), fie 1 gram. Masa oxigenului care se combina cu carbonul pentru a forma primul oxid este 1,33 grame, iar pentru formarea celui de-al doilea oxid este de 2,66. Raportul acestor mase este 2,66 : 1,33 = 2 : 1, deci un raport simplu de numere intregi
Ca o concluzie evidenta privind observatiile aplicarii legii proportiilor multiple pentru cazul oxizilor de azot si carbon, putem afirma ca raporturile simple ale maselor apar ca urmare a raporturilor simple ale atomilor care participa la formarea compusului respectiv (molecula individuala). Ca urmare se pot stabilii urmatoarele postulate privind Teoria atomico - moleculara:
.elementele sunt constituie din atomi identici
. toti atomii unui element simplu au aceleasi caracteristici ale masei
. nici numarul, nici masa unui anumit element nu se modifica in decursul unei reactii chimice
. compusii constituiti din acelasi tip de molecule au raportul atomilor reprezentat prin numar intreg.
Mase atomice relative si formule empirice
Considerand postulatele Teoriei Atomio-moleculare, anuntate anterior, precum si consecintele derivat din Legea conservarii masei, Legea proportiilor finite, Legea proportiilor multiple, putem merge mai departe in stabilirea relatiilor care exista intre masele atomilor componenti ai unei substante si posibilitatea lamuririi modului de exprimare a combinatiei respective printr-o formula clara . Concluzia principala din cele prezentate anterior este ceea privind faptul ca atomi se combina in raporturi simple atunci cand formeaza un compus.
Observatia 3. Sa mergem mai departe si sa considera urmatoarea observatie asupra Relatiilor volumelor in cursul reactiilor chimice.
Cu toate ca masa este conservata in majoritatea reactiilor chimice, majoritatea proprietatilor fizice si chimice nu se conserva in timpul acestor reactii! Una din proprietatile care nu se conserva este volumul, in special atunci cand reactioneaza elemente in stare gazoasa sau cand produsul de reactie este gaz. Cel mai simplu exemplu este reactia oxigenului cu hidrogenul, cu formarea apei sub forma de vapori. Daca luam 1 litru de oxigen si-l punem sa reactioneze cu 2 litrii de hidrogen, ambele in stare gazoasa, vom observa, la o analiza atenta ca din aceste volume s-au format 2 litri de apa in stare de vapori. Observam ca volumul total nu s-a "conservat", adica amestecul de 3 litri hidrogen si oxigen s-a transformat in doar 2 litri apa in stare de vapori (gaz) (Obs. toate volumele gazoase s-au determinat in aceeasi conditii de temperatura si presiune.) Dar mai interesant este de notat ca volumele implicate in reactie se regasesc in forma unui raport de numere intregi: 1 litru oxigen : 2 litrii hidrogen : 2 litrii apa. Aceste rezultate par sa fie generale in cazul reactiilor care implica substante in stare gazoasa. De exemplu 1 litru azot gazos reactioneaza cu trei litrii de hidrogen pentru a forma 2 litrii de amoniac gazos. Sau alt exemplu: un litru de hidrogen (gaz) se combina cu un litru clor (gaz) pentru a rezulta 2 litrii acid clorhidric (gaz). Aceste observatii duc la formularea Legii de combinare a volumelor
Legea 4: Legii de combinare a volumelor
Atunci cand gazele se combina in parcursul reactiilor chimice, la temperatura si presiune constante, raportul lor de combinare volumica este reprezentat de un numar intreg.
Aceste raporturi reprezentate prin numere intregi sunt frapant de concludente, in special in lumina legii proportiilor multiple. Atomii se combina intr-un raport care reprezinta un numar intreg, si evident, volumele de gaze se combina la fel.
Oare de ce? O explicatie simpla a acestei similitudini ar fi ca raportul volumic si ca raportul atomic sau molecular intr-o reactie sunt identice. In cazul hidrogenului si oxigenului, putem spune raportul volumelor (1 litru oxigen : 2 litrii hidrogen : 2 litrii apa) este acelasi ca si raportul atomilor si moleculelor (1 atom of oxigen: 2 atomi hidrogen: 2 molecule de apa). Pentru ca acestea sa fie adevarate trebuie ca volume egale de gaze sa contina un numar egal de particule (atomi sau molecule), indiferent de natura gazului. Daca asta este adevarat asta inseamna ca volumul gazos trebuie sa fie o masura directa a numarului de particule (atomi sau molecule) a respectivului gaz. Asta ar permite "numararea" numarului particulelor unui gaz si determinarea formulei moleculare.
Totusi, aceasta concluzie formulata anterior pare sa aiba un mare semn de intrebare: daca privim inapoi la datele privind formarea acidului clorhidric, adica: 1 litru hidrogen plus 1 litru clor formeaza 2 litrii de HCl! Daca judecata noastra este corecta atunci aceasta este echivalent a spune ca un atom de hidrogen plus un atom de clor formeaza doua molecule de acid clorhidric!!! Dar cum este asta posibil?? Cum putem crea doua molecule identice de acid clorhidric dintr-un singur atom de clor si un singur atom de hidrogen???? Asta ar insemna sa violam postulatele teoriei atomo-moleculare!!
O alta problema apare la "cantarirea" gazelor : un litru de oxigen cantareste mai mult ca un litru de apa in stare de vapori Daca presupunem ca aceste volume contin un numar egal de particule, atunci trebuie sa concluzionam o parte in greutate de oxigen cantareste mai mult decat un volum de apa. Dar cum poate fi asta posibil?! Se pare ca molecula de apa, care contine cel putin un atom de oxigen, ar trebui sa cantareasca mai mult decat o singura particula de oxigen. Exista astfel obiectii serioase la ideea ca volume egale de gaze contin un numar egal de particule. Postulatul nostru pare sa vina in contradictie cu observatiile experimentale. Totusi, raportul combinatoriu simplu al Legii de combinare volumica este de asemenea restrictiv. Cum pot volumele sa reactioneze in proportiile unor numere intregi simple, daca ele nu reprezinta un numar egal de particule? Sa consideram si punctul de vedere opus: daca volume egale de gaze nu contin un numar egal de particule, ar trebuie ca un numar egal de particule sa fie regasite in volume diferite al caror proportie ar fi diferita de un numar intreg! In consecinta, atunci cand vom combina particule pentru a forma molecule in raporturi echivalente unor numere intregi simple, volumele de gaz necesare nu vor fi in raporturi favorabile numerelor intregi; in consecinta Legea de combinare a volumelor nu poate fi validata!
Exista o singura cale logica de evadare din acest marasm: trebuie sa acceptam prin deductie din Legea de combinare a volumelor ca volume egale de gaz contin un numar egal de particule, concluzie bine cunoscuta in teoria chimica drept Ipoteza lui Avogadro. Cum putem socotii ca 1 litru de hidrogen si un litru de clor duc la formarea a 2 litrii de acid clorhidric? Concluzia pare clara: doar daca o particula de hidrogen contine mai mult de un atom de hidrogen. In realitate fiecare particula (molecula) de hidrogen ar trebui sa contina un numar par de atomi de hidrogen. In mod similar o molecula de clor ar trebui sa contina un numar par de atomi de clor. Mai explicit, observam ca:
1 litru hidrogen + 1 litru clor 2 litrii HCl (2)
Presupunand ca fiecare litru contine acelasi numar de particule, atunci putem interpreta aceasta observatie ca:
![]()
Acesta este un rezultat minunat pentru contabilizarea corecta a Legii de combinare a volumelor si elimina temerile noastre privind cererea de noi atomi. Mai important este faptul ca acum cunoastem formula acidului clorhidric; am gasit de fapt o modalitate de "contabilizare" a atomilor participanti in reactie prin masurarea volumului gazelor care reactioneaza.
Aceasta metoda este utila pentru determinarea formulei moleculare a multor compusi. De exemplu:
![]()
Ar rezulta ca particulele de oxigen contin un numar par de atomi de oxigen, Acum putem interpreta aceasta ecuatie ca
![]()
Acum, ca cunoastem formula moleculara a apei putem sa tragem concluzii definitive privind masele relative ale hidrogenului si oxigenului. Sa ne reamintim ca raportul masic din apa este de 8 : 1 oxigen : hidrogen. Deoarece sunt doi atomi de hidrogen pentru fiecare atom de oxigen, rezulta ca masa atomului de oxigen este de 16 ori mai mare decat masa atomului de hidrogen. Continuarea acestor determinari privind stabilirea formulei empirice si moleculare vor fi dezbatute in cadrul tematicilor de seminar.
Structura atomica
Incepem prin stabilii ca punct de start teoria atomo-moleculara. Prin aceasta presupunem ca majoritate elementelor au fost deja identificate si fiecare astfel de element este constituit din atomi identici, indestructibili. Mai presupunem ca greutatile atomice ale elementelor sunt deja cunoscute si in consecinta este posibil, prin intermediul masuratorilor compozitiei masice, sa determinam formula moleculara a oricarui element. In plus, presupunem ca a fost deja efectuat experimente electrochimice care au demonstrat cp atomii contin sarcini pozitive si negative in numar egal. In final sa presupunem ca intelegem Tabelul Periodic. In plus trebuie sa presupunem ca elementele se pot grupa dupa proprietatile lor fizice si chimice si ca aceste proprietati sunt functii periodice determinate de numarul atomic.
Teoria atomo-moleculara este extrem de folositoare pentru explicarea modului de formarea compusilor din elementele componente. Aceasta consta in a afirma ca un compus este alcatuit de molecule identice, fiecare continand atomi ai elementelor aflati intr-un raport numeric intreg. Totusi, ceea ce cunoastem noi despre acesti atomi este foarte limitat. Singura proprietate pe care o putem afirma drept cunoscuta la momentul actual este masa relativa a fiecarui atom. Drept consecinta noi nu putem inca raspunde la o serie de intrebari. Avem nevoie de modele care sa ia in considerare periodicitatea proprietatilor fizice si chimice asa cum sunt ele reprezentate prin Tabelul Periodic. De ce sunt elementele foarte diferite in privinta maselor atomice in timp ce au proprietati aproape similare? De ce aceste proprietati se manifesta periodic?
Am dori sa intelegem care sunt factorii care determina numarul fiecarei specii atomice care participa la formarea unui compus stabil. De ce oare exista combinatii recunoscute usor in timp ce altele nu pot fi observate? Cum este posibil ca doua elemente cu mase atomice complet diferite (de exemplu clorul si iodul) sa formeze compusi cu proprietati chimice aproape similare?
De ce elemente cu mase atomice diferite (de exemplu, oxigen si azot) formeaza compusi complet diferiti? In general, care sunt oare fortele care "tin in contact" atomii care formeaza moleculele, dar care sunt fortele care "tin in contact" moleculele in structurile nou create prin interactiunea lor?
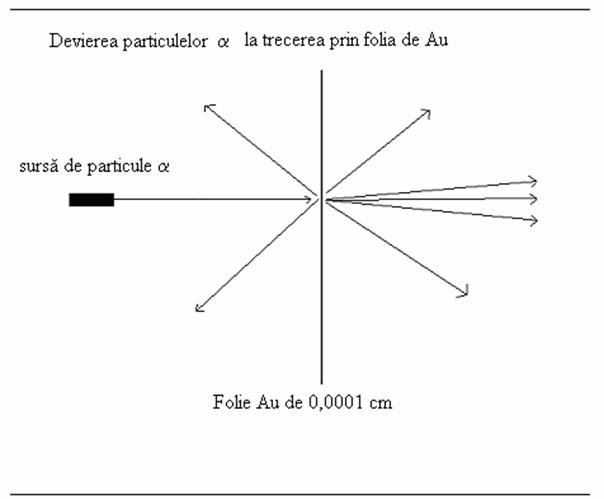
Figura 1
Raspunsul la aceste intrebari necesita nu doar cunostinte asupra structurii atomului, dar si modul in care structurile atomilor diferitelor elemente sunt complet diferite.
Sa luam in considerare experimentul devierii particulelor a de catre atomi. Daca am considerat ca atomii contin atat sarcini pozitive cat si sarcini negative si ca numarul acestor sarcini este egal pentru o anumita specie atomica, totusi nu putem sti nici numarul atomilor implicati, nici modul in care sarcinile interne sunt implicate in formarea combinatiei. Pentru a determina repartizarea sarcinilor in cadrul unui atom trebuie sa efectuam un experiment de "scanare", ideea fiind persuativa: deoarece nu punem sa "vedem" structura atomica, vom incerca sa privim "prin" atom. Atomii alesi au fost cei prezenti intr-o folie de Au de 10−4cm. Ceea ce noi trimitem drept "bombardiere" sunt de fapt particule incarcate pozitiv, masive masic, emise de nuclee radioactive de poloniu. Particulele a sunt directionate pe o directie foarte focalizata si perpendiculara pe folia de aur, asa cum este de fapt reprezentata in Figura 1.
Rezultatul experimentului pare initial contra-intuitiv. Majoritatea particulelor a trec prin folia de aur nemodificandu-si directia initiala, ca si cand nu ar fi fost nimic in calea lor! Un mic numar de particule a sunt insa deplasate din directia lor de propagare iar o foarte mica parte din particulele trimise prin bombardament sunt reflectate de folia de aur. Cum putem oare contabiliza simultan lipsa deplasarii pentru majoritatea particulelor a cu cea a particulelor care sunt deplasate, respectiv cu numarul mic de particule total reflectate? In primul rand, deoarece majoritatea particulelor a pozitive care trec prin folia de aur fara a-si modifica traiectoria, putem concluziona ca majoritatea spatiului volumului atomic al fiecarui atom de aur este un spatiu liber (gol), ce nu contine nimic capabil sa devieze particulele a. In al doilea rand, deoarece un numar mic de particule a sunt deplasate foarte puternic, aceasta insemna ca in calea lor au intalnit particule pozitive masive in volumul respectiv al atomului. De aici si prima noastra concluzie si anume ca majoritatea masei atomice este concentrata in nucleu. Nucleul trebuie sa fie foarte mic, foarte masiv si incarcat pozitiv. Un calcul detaliat pe baza celor enuntate anterior ar conduce la concluzia ca nucleul ar trebui sa de circa 100 000 ori mai mic decat atomul insasi. Electronii, particule deja recunoscute a exista in atom, trebuie sa se situeze in afara nucleului intr-un spatiu mult mai mare al atomului. In plus, in total, electronii au o pondere masica mai mica de 0.05% a masei atomice.
Sa mai facem un experiment si sa-l analizam: emisia razelor X. Cu toate ca deja putem enunta ca sarcinile pozitive sunt concentrate intr-o regiune foarte mica, definita nucleu, iar cele negative, definite drept electroni se gasesc intr-un spatiu mult mai mare care inconjoara nucleul, nu avem inca nici o informatie concreta asupra numarului de electroni are se misca in jurul nucleului intr-un volum mult mai mare decat cel ocupat de nucleu., sau asupra felului in care depinde numarul de electroni pentru o anumita specie atomica. Are oare atomul de aur acelasi numar de electroni ca si atomul de argint? Singurul lucru cert pe care il putem afirma este ca numarul sarcinilor pozitive din nucleu trebuie sa fie egal cu numarul sarcinilor negativ, respectiv al electronilor, care graviteaza in jurul nucleului deoarece fiecare atom este neutru din punct de vedere electric (daca consideram in special starea lui fundamentala - stare in care el este definit ca atom nesupus altor interactii decat cele care au loc in intimitatea lui structurala). Prima problema care apare acum este stabilirea numarului particulelor elementare ale unui atom. Daca examinam frecventa emisie razelor x emise de atomii excitati de un arc electric. Fiecare tip de atom (respectiv element) emite cateva frecvente caracteristice ale emisie razelor X, diferite de la atom al atom. Cea mai joasa frecventa a razelor X pentru fiecare element (atom) este regasita printr-un incrediment odata cu cresterea pozitiei in tabelul periodic. Si mai uimitor este relatia neasteptata dintre frecventa si masa relativa a fiecarui atom. Haideti sa ordonam elementele in functie de masele lor atomice, presupunand ca fiecare din aceste mase sunt reprezentate printr-un numar intreg. In Tabelul periodic, aceasta ordonare ar corespunde de fapt pozitiei elementului respectiv in acest tabel. Hidrogenul se afla in pozitia 1, heliul in pozitia 2, etc. Daca raportam acum cea mai mica frecventa la numarul atribuit din tabelul periodic vom descoperii ca frecventa creste ca functie directa a cresterii numarului de ordine.
Aceasta este reprezentata sugestiv in Figura 2, figura in care radicalul patratic al frecventei razelor x este exprimata drept functie de numarul de ordine din tabelul periodic. O corectie foarte mica determina o relatie liniara dintre aceste numere (singura corectie este cea a ordini argonului si potasiului, care trebuie inversate)
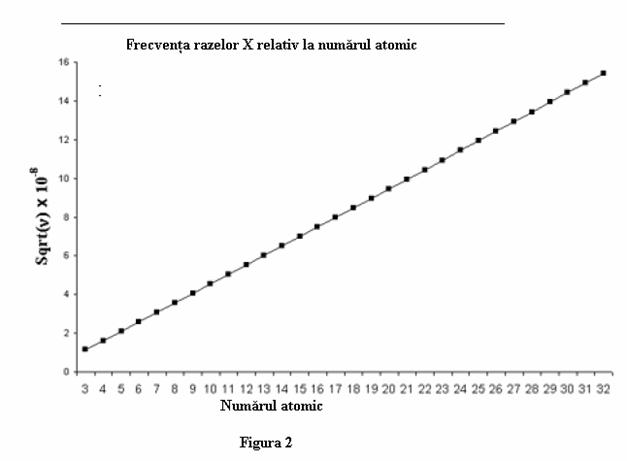
De ce oare aceasta relatie simpla este mai mult decat o surpriza? Deoarece clasificarea elementelor in functie de numarul intreg al masei nu pare a fi o proprietate fizica. Putem afirma insa ca numerele atribuite elementelor le-am descoperit a fi in intr-o relatie cantitativa foarte simpla dintre o entitate fizica (frecventa razei X) si numarul de ordine atribuit. In plus nu se observa nici o "pauza" in linia determinata grafic, fapt ce ne duce la concluzia ca toate elementele trebuie sa se insire conform masei lor. (din nou figura 2). Ambele observatii scot in evidenta ca clasificarea fiecarui atom trebuie totusi sa urmeze o anumita proprietate fizica reala, legata direct de proprietatile structurale ale fiecarui atom. Acum putem discuta asupra numarului atomic, deoarece acest numar caracterizeaza UNIC fiecare atom. In plus, stim ca fiecare atom contine un numar intreg de sarcini pozitive. Deoarece prin razele X se demonstreaza o proprietate fizica, numarul atomic, care este de asemenea un numar intreg, trebuie sa se inteleaga ca numarul atomic derivat prin determinari ale razelor X reprezinta determinarea sarcinilor totale pozitive, iar prin analogie, prin electro-neutralitatea atomului, cea a sarcinilor negative. Consecinta a acesteia este observatia ca in cazul unui atom aflat in stare fundamentala, numarul atomic al elementului respectiv este identic egal cu numarul atomic .
Am reusit astfel sa cunoastem destul de multe lucruri asupra structurii atomului: faptul ca are o structura nucleara in care sunt concentrate sarcinile pozitive, dar si ponderea masica principala, dar mai stim si numarul de protoni si de electroni pe care un element (atom) il contine. Din pacate nu cunoastem inca nimic asupra pozitiilor si miscarilor electronilor in imensul spatiu din jurul nucleului.
Sa luam in considerare un element esential: energia de ionizare a atomilor
Fiecare electron trebuie sa se miste in jurul atomului intr-un camp electric generat de incarcatura pozitiva a sarcinilor pozitive prezente in nucleu, dar si campul electric negativ determinat de ceilalti electroni. Legea lui Coulumb determina energia potentiala de atractie a fiecarui electron de catre nucleu:
![]() (5)
(5)
unde (+Z) este sarcina nucleului atomului cu numar atomic Z si −e este sarcina electronului, r fiind distanta dintre electron si nucleu. Energia potentiala a unui electron intr-un atom este astfel negativa. Aceasta se datoreaza faptului ca energia potentiala a electronului, aflat la distanta mare de nucleu tinde spre zero. Ca o consecinta a legii lui Coulumb ne asteptam ca electronii aflati mai aproape de nucleu sa aiba o energie potentiala mai mica si in consecinta sa necesita o energie mai mare pentru a fi eliminati din sistem. Putem totusi determina acum energia necesara eliminarii unui electron dintr-un atom.
Conform legii lui Coulumb, ne putem astepta ca atunci cand electroni se afla mai aproape de nucleu energia lor potentiala sa fie mai mica, determinand astfel solicitarea energetica in eliminarea lor. Putem acum masura direct energia necesara eliminarii unui electron din atom. Fara a ne interesa cum este facuta aceasta determinare, nu facem altceva decat sa masuram energia necesara efectuarii "reactiei de ionizare"
![]()
Aici A este un atom in stare gazoasa si A+ este acelasi atom dar care are mai putin un electron care a fost "smuls". Energia minima necesara pentru realizarea ionizarii este definita drept energie de ionizare. Valorile energiilor de ionizare a fiecarui atom din grupele I pana la VIII din tabelul periodic sunt functie de numarul atomic.
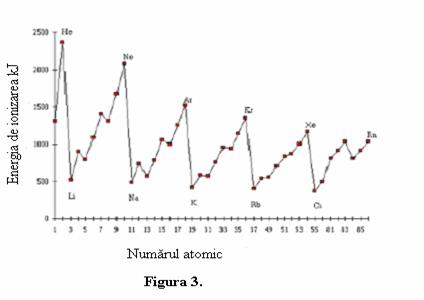
Aceasta figura este reminiscenta Legii periodicitatii, care statueaza ca proprietatile fizice si chimice ale unui element sunt functii periodice ale numarului atomic. Sa notam ca elementele cu cea mai mare energie de ionizare sunt gazele inerte, iar cele mai mici energii de ionizare sunt ale metalelor alcaline. Dupa cum se observa din figura pentru o perioada aceasta energie de ionizare creste pana la gazul inert din capatul perioadei, scazand brusc pentru metalul alcalin din urmatoarea perioada. Este nevoie de un model care sa tina cont de aceste variatii ale energiei de ionizare. O ipoteza rezonabila din Legea lui Coulomb ar fi ca aceasta variatie a "incarcarii" nucleului (numarul atomic) si de distanta electronilor fata de nucleu. Pentru inceput sa admitem o aproximatie grosiera a energiei de ionizare ca valoare negativa a energiei de atractie determinata prin legea lui Coulumb. Este desigur o aproximatie grosiera deoarece nu tine cont de energia cinetica dar si pentru faptul ca electronii nu se gasesc la valori fixe ale razei fata de nucleu. Cu toate acestea aceasta aproximare permite stabilirea unei modalitati cele explicitate in figura 3. De exemplu, din legea lui Coulumb pare sa admita ca energia de ionizare trebuie sa creasca odata cu numarul atomic. Este mai usor sa smulgi un electron din Litiu decat din Neon deoarece sarcina nucleara a litiului este mai mica decat cea a neonului. Logic ar trebui ca atomul de sodiu sa aiba valoarea energie de ionizare mai mare decat a neonului, in realitate insa observam ca energia de ionizare a sodiului este mult mai mica. Aceasta observatie ramane valabila la fiecare trecere intr-o noua perioada. Ce am omis oare din aceasta analiza?
Raspunsul consta in faptul ca trebuie sa luam in considerare si distanta electronilor fata de nucleu. Deoarece este necesara o energie mai mica pentru ionizare in cazul sodiului este mai mica decat cea a neonului cu toate ca sodiul are o sarcina nucleara mai mare, trebuie sa admitem ca electronul care trebuie eliminat din atomul de sodiu se ala la o distanta mai mare de nucleu fata de cazul neonului. Pe de alta parte, deoarece energia de ionizare creste aproape liniar de la litiu la neon, in perioada a doua, aceasta releva faptul ca electronii sunt tot mai puternic atrasi de nucleele mai incarcate si sugereaza ca distanta electronilor fata de nucleu nu variaza foarte mult pentru cazul unei perioade din tabelul periodic.
Daca urmam aceasta observatie putem chiar estima cam cat de departe de nucleu se afla un electron utilizand aproximatia grosiera ca energie de ionizare este egala cu potentialul Coulumbian cu semn schimbat (negativ) si determinand raza fata de nucleu a fiecarui electron. Acestea vor estima distanta electronului fata de nucleu:
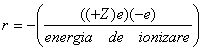 (7)
(7)
Valorile astfel calculate pentru primele douazeci elemente din tabelul periodic sunt prezentate in figura 4. Pentru comparare sunt prezentate si energiile de ionizarea acestor elemente. Interesant de notat ca razele cresc la fel ca si energiile de ionizare
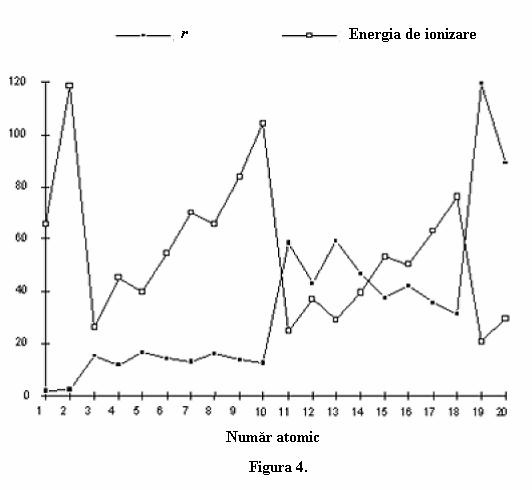
Valorile r astfel calculate sunt prezentate pentru primele douazeci de elemente. Pentru o mai usoara comparatie sunt prezentate concomitent valorile energiei de ionizare pentru atomii respectivi (Figura 4)de notat ca distanta aproximativa fata de nucleu a electronilor creste in trepte aproape identice cu energia de ionizare.
Cu toate ca distantele calculate astfel nu au un inteles fizic precis, din figura 4 se pot sugera cateva concluzii importante. Electronii sunt aranjati in elemente in "invelisuri" (straturi) aflate la distante tot mai indepartate de nucleul atomic. Hidrogenul si heliul, care au unul, respectiv doi electroni, au energii de ionizare corespunzatoare unor electroni aflati la distante similare sau apropiate fata de nucleu. Apoi elementele perioadei a doua litiu la neon au dimensiuni ale energiilor de ionizare virtual identice, ceva mai inalte decat a elementelor perioadei intai. Elementele grupei a treia, sodiu la argon au o distanta aproximativ a electronilor fata de nucleu care fluctueaza putin, ceva mai mare ca a elementelor din grupa a doua.
Deoarece dimensiunile atomilor par sa creasca in trepte care corespund exact perioadelor din tabelul periodic al elementelor, se pare electronii unui atom sunt grupati in agregate aflate la distante diferite de nucleu. Primii doi electroni, exemplul fiind heliu sunt apropiati de nucleu, in timp ce electroni aditionali, cum sunt cei care apar in elementele perioadei a doua, litiu - neon, au primii doi electroni intr-un prim strat interior, in timp ce ceilalti intr-un al doilea strat, exterior. Acest model al staturilor interioare si a stratului exterior poate fi acum extins pentru celelalte perioade Putem redefini acest model al straturilor considerand o analiza mai avansata privind starea de ionizare. Teoretic, putem smulge dintr-un atom, electroni in secvente succesive, formandu-se ioni cu sarcini din ce in ce mai mari. Pana acum am examinat cazul ionizarii unui electron dintr-un atom, sau cu alte cuvinte prima energie de ionizare EI1, dar pentru fiecare electron extras ulterior valoarea acestei energii de ionizare va fi mai mare:
Prima energie de ionizare EI1
![]()
A doua energie de ionizare EI2
![]()
A treia energie de ionizare EI3
![]()
Ordinea secventionala a energiilor de ionizare pentru elementele celei de-a doua perioade sunt prezentate sub forma tabelara mai jos.
Energii de ionizare succesive (kJ/mol)
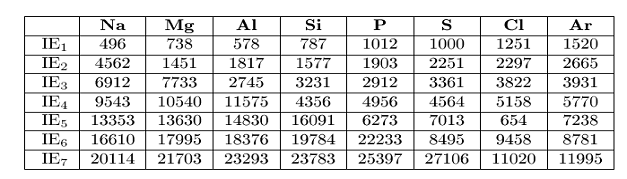
De notat ca cea de a doua energie de ionizare este intotdeauna mai mare ca prima, iar a tria energie de ionizare este intotdeauna mai mare ca a doua, si asa mai departe. Lucru acesta pare logic deoarece odata cu parasirea atomului de catre primul electron, prin destramarea electroneutralitatii atomului, sarcina pozitiva devine superioara celei negative, respectiv cu cat numarul electronilor eliminati este mai mare cu cat mai mult va creste forta cu care nucleul tine legati electronii. Totusi, datele prezentate in tabelul anterior par sa aiba anumite trasaturi surprinzatoare. In majoritatea cazurilor, energia de ionizare creste destul de mult pentru ionizari succesive. Dar, pentru fiecare atom exista intotdeauna o energie de ionizare maxima a secventei. Pentru sodiu ca exemplu EI2 este de zece ori mai mare decat EI1. Similar EI3 este de cinci ori mai mare in cazul Mg, cu toate ca EI2 este ceva mai putin decat dublul lui EI1.
Daca privim acum atent si numaram electronii, vom observa ca aceasta crestere neobisnuit de mare pentru energia de ionizare se datoreaza faptului ca am extras toti electronii dintr-o strat exterior si ne ocupam de electroni din straturi interne. Acest fapt este bine reliefat in exemplu luat cel al elementelor perioadei a doua. Concluzia este clara: completarea unui strat interior coincide cu structura electronica a gazului inert precedent perioadei, putand definii acum numarul de electroni posibili a se regasii intr-un anumit strat. Electronii care se regasesc si care completeaza stratul exterior definesc ceea ce este astazi recunoscut drept strat de valenta. Intrebarea la care nu am reusit sa gasim inca raspuns este de ce doar un anumit numar limitat de electroni este acceptat pe un anumit strat electronic. Nu avem inca argumente pentru a defini de ce electronii nu se impacheteaza cat mai aproape de nucleu, sau de ce numarul de electroni corespunzatori gazelor inerte reprezinta exact numarul care completeaza stratul exterior (de valenta). La toate aceste intrebari si la altele raspunsul il vom afla mai tarziu.
|
Politica de confidentialitate | Termeni si conditii de utilizare |

Vizualizari: 6944
Importanta: ![]()
Termeni si conditii de utilizare | Contact
© SCRIGROUP 2025 . All rights reserved