| CATEGORII DOCUMENTE |
| Astronomie | Biofizica | Biologie | Botanica | Carti | Chimie | Copii |
| Educatie civica | Fabule ghicitori | Fizica | Gramatica | Joc | Literatura romana | Logica |
| Matematica | Poezii | Psihologie psihiatrie | Sociologie |
Ecuatia van der Waals (1873) decurge din ecuatia de stare a gazelor perfecte prin introducerea a doua constante de corectie: a si b.
La deducerea legii gazelor perfecte s-a facut abstractie de fortele de atractie care actioneaza intre molecule. De asemenea, s-a neglijat volumul propriu al moleculelor.
Cele doua constante de corectie corespund celor doua interactiuni: de atractie si de respingere intermoleculara.
a) Corectia pentru atractia intermoleculara
Intre molecule actioneaza forte de atractie numite forte de coeziune. Ele actioneaza in acelasi sens cu presiunea externa (p) si fac gazul mai compresibil de cum ar cere legea generala a gazelor perfecte. Aceste forte echivaleaza cu un supliment de presiune, adica cu o presiune interna (pi) care se adauga presiunii externe p.
Fortele de coeziune trebuie sa fie direct proportionale atat cu numarul moleculelor din unitatea de volum care atrag (N), cat si cu numarul moleculelor care sunt atrase si se afla in aceeasi unitate de volum (N).
Deci forta de atractie, respectiv presiunea interna, trebuie sa fie direct proportionala cu patratul numarului de molecule (N2). Dar numarul de molecule N din unitatea de volum este proportional cu densitatea gazului, iar aceasta este invers proportionala cu volumul gazului. Prin urmare, corectia de presiune numita presiune interna este de forma:
![]() (2.56)
(2.56)
unde: a = constanta individuala caracteristica substantei.
b) Corectia pentru respingerea intermoleculara
Respingerea intermoleculara la presiuni mari cand moleculele sunt inghesuite, face ca acestea sa nu mai poata fi considerate punctiforme, ci avand dimensiuni finite cu un volum propriu molecular care trebuie scazut din volumul V pe care l-ar ocupa gazul perfect. Corectia de volum se numeste covolum (b) si depinde de natura chimica a substantei.
Introducand cele doua corectii in legea generala a gazelor perfecte se obtine ecuatia van der Waals pentru gazele reale (raportata la 1 mol de gaz):
![]() (2.57)
(2.57)
Ecuatia van der Waals este o ecuatie de gradul trei in raport cu volumul:
pV3 - (bp + RT)V2 + aV - ab = 0 (2.58)
Parametrii critici (pc, Vc, Tc) pot fi calculati din ecuatia van der Waals.
Impartind ecuatia (2.58) cu presiunea, se obtine relatia:
![]() (2.59)
(2.59)
Din aceasta ecuatie parametrii critici se determina, tinand cont de faptul ca in punctul critic cele trei radacini ale ecuatiei de gradul trei (2.59) coincid (avand un punct de inflexiune: V1=V2=V3=Vc). Deci ea poate fi scrisa sub forma:
(V - Vc)3 = V3 - 3VcV2 + 3Vc2V - Vc3 = 0 (2.60)
Identificand coeficientii ecuatiei (2.60) cu cei din ecuatia (2.59) pentru valorile pc, Vc si Tc, se obtine:
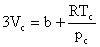 (2.61)
(2.61)
![]() (2.62)
(2.62)
![]() (2.63)
(2.63)
Din ecuatiile (2.61), (2.62) si (2.63) rezulta parametrii critici:
![]() (2.64.a)
(2.64.a)
![]() (2.64.b)
(2.64.b)
![]() (2.64.c)
(2.64.c)
Pe baza relatiilor (2.64.a), (2.64.b) si (2.64.c), se poate determina factorul de compresibilitate critic pentru toate gazele (zc):
![]() (2.65)
(2.65)
O alta metoda de determinare a parametrilor critici se bazeaza pe faptul ca punctul critic este un punct de inflexiune pe izoterma critica. Pentru temperaturi T < Tc avem doua puncte de inflexiune (fig. 2.6.), un minim si un maxim. Ecuatia van der Waals (2.57) poate fi scrisa la punctul critic, sub forma:
![]() (2.66)
(2.66)
Inflexiunea curbei se determina prin anularea derivatelor de ordinul I si II ale lui p = f(V). Aplicand acest procedeu asupra ecuatiei (2.66) se obtine:
 (2.67)
(2.67)
 (2.68)
(2.68)
Impartind ecuatiile (2.67) si (2.68) membru cu membru, se obtine:
Vc = 3b
si apoi pe baza ecuatiilor (2.67) si (2.66) rezulta Tc, respectiv pc.
La presiuni mari si foarte mari se utilizeaza ecuatia Beattie-Bridgemann ce contine parametrii de corectie suplimentari. Ecuatia van der Waals este valabila pentru presiuni mici.
|
Politica de confidentialitate | Termeni si conditii de utilizare |

Vizualizari: 5861
Importanta: ![]()
Termeni si conditii de utilizare | Contact
© SCRIGROUP 2026 . All rights reserved