| CATEGORII DOCUMENTE |
| Alimentatie nutritie | Asistenta sociala | Cosmetica frumusete | Logopedie | Retete culinare | Sport |
SOCUL
(STARILE DE SOC)
Definitie
Termenul de soc a fost utilizat pentru prima data in 1743, in traducerea engleza a unui tratat despre ranile de razboi publicat in Franta de Henri Francois Le Dron. In decursul timpului, termenul de soc si-a imbogatit progresiv continutul, ajungand sa cuprinda stari clinice grave determinate de factori etiologici diversi, dar care au ca element comun o perturbare acuta severa a perfuziei tisulare si a metabolismului celular.
In prezent, socul poate fi definit ca un sindrom clinic acut caracterizat prin hipoperfuzie tisulara globala sau perfuzie tisulara inadecvata nevoilor tisulare ,avand ca reazultat final,in lipsa unei terapii eficace disfunctia severa a organelor vitale si apoi decesul.
Hipoperfuzia tisulara/ perfuzia tisulara inadecvata are drept consecinta un aport inadecvat de oxigen, produce o afectare progresiva a metabolismului celular care se manifesta prin disfunctii/leziuni organice multiple si/sau moarte.
Clasificare
Daca tulburarea perfuziei tisulare ce caracterizeaza socul trebuie inteleasa atat ca hipoperfuzie absoluta (scaderea fluxului sanguin tisular), cat si ca hipoperfuzie relativa in cazul socului septic (flux sanguin normal sau chiar crescut), dar oricum insuficienta pentru asigurarea unui aport de oxigen si substrat energetic corespunzator consumului,atunci problema fiziopatologica centrala a socului se poate reduce la existenta unui dezechilibru intre aportul de oxigen sistemic (DO2) si consumul de oxigen la nivel tisular (VO2).
Cauzele care produc dezechilibrul DO2/VO2 sunt multiple, dar pot fi grupate dupa mecanismele prin care actioneaza.
Pentru intelegerea acestor mecanisme trebuie definite variabilele transportului de oxigen:
DO2= IC x CaO2 unde
DO2 reprezinta transportul (aportul) de oxigen
IC reprezinta indexul cardiac
CaO2 reprezinta continutul arterial de oxigen
CaO2 = SaO2 x 1,36 x Hgb + (0,031 x PaO2), unde
SaO2, este saturatia in oxigen a hemoglobinei in sangele arterial
PaO2, este presiunea partiala a oxigenului in sangele arterial
VO2 = IC x (CaO2 - CvO2), unde
VO2 reprezinta consumul global de oxigen
IC este indexul cardiac
CaO2 este continutul arterial in oxigen
CvO2 este continutul in oxigen al sangelui venos amestecat (din artera pulmonara)
CvO2 = SvO2 x 1,36 x Hgb + (0,0031 x PvO2), unde
SvO2, este saturatia in oxigen a hemoglobinei din sangele venos amestecat
PvO2 este presiunea partiala a oxigenului din sangele venos amestecat.
Dezechilibrul intre DO2 si VO2 se poate produce prin urmatoarele mecanisme:
- I. Scaderea aportului de oxigen (DO2)
-II. Cresterea consumului de oxigen (VO2) in conditiile unui aport de oxigen (DO2) normal sau chiar crescut, dar insuficient pentru acoperirea nevoilor.
I. Scaderea aportului de oxigen (DO2) este determinata de reducerea debitului cardiac (indexul cardiac) prin:
Reducerea presarcinii (scaderea volumului de sange din ventriculul stang la sfarsitul diastolei, in contextul scaderii volumului sanguin circulant). Cauzele care determina scaderea volumului circulant sunt multiple, dar fiziopatologia fiind comuna sunt grupate sub denumirea de soc hipovolemic.
Reducerea performantei de pompa a cordului. Cauzele determinante ale scaderii performantei de pompa a cordului sunt diverse, dar opereaza in principal prin acelasi mecanism patogenic si sunt grupate sub denumirea de soc cardiogen.
Pe plan hemodinamic, scaderea debitului cardiac - atat prin scaderea volumului sanguin circulant cat si prin scaderea performantei de pompa cardiaca determina o reactie de tip hipodinamic manifestata clinic prin:
semne de hipoperfuzie tisulara (semne simple, usor de cules si interpretat):
● tahicardie
● extremitati reci,umede
● scaderea presiunii arteriale medii
● modificarea starii de constienta (obnubilare, agitatie);
● scaderea debitului urinar(oligurie)
scaderea presiunii pulsului (scaderea diferentei dintre presiunea arteriala maxima si presiunea arteriala minima)
timp de umplere capilara prelungit.
Din punct de vedere paraclinc, reactia hipodinamica se caracterizeaza prin :
index cardiac (IC) scazut
rezistente vasculare sistemice ( RVS) crescute
presiuni de umplere (PVC,PCP): ● mult scazute in socul hipovolemic
● mult crescute in socul cardiogen.
II. Cresterea consumului de oxigen (VO2) in conditiile unui DO2 normal sau chiar crescut caracterizeaza socul septic care apare frecvent ca o complicatie a infectiilor severe. Pe plan hemodinamic socul septic determina o reactie hiperdinamica manifestata clinic prin:
tahicardie (si alte semne de SIRS) si tendinta la hipotensiune
presiunea pulsului crescuta;
presiunea diastolica scazuta;
extremitati calde;
timp de umplere capilara normal;
semne de sepsis.
Din punct de vedere paraclinc, reactia hiperdinamica se caracterizeaza prin :
index cardiac (IC) crescut
rezistente vasculare sistemice ( RVS) scazute
presiuni de umplere (PVC,PCP) normale sau usor scazute
In faza precoce a socului se poate identifica o singura cauza primara care perturba circulatia. Asocierea hipovolemiei sau a afectarii miocardice la un pacient cu soc septic se vor evidentia bineinteles ca o reactie hipodinamica si nu una hiperdinmica, dar terapia corecta a acestor dezechilibre va restabli tabloul clinic de reactie hiperdinamica.
In mod practic eliminarea sechelelor socului si succesul tratamentului aplicat depind de recunoasterea prompta si corectarea acestei perturbari hemodinamice initiale.
Cea mai larg acceptata clasificare a starilor de soc in functie de mecanismul declansator este cea facuta de Weil si Shubin care descriu patru tipuri majore de soc: hipovolemic, cardiogen, extracardiac obstructiv si socul distributiv.
Este de mentionat faptul ca aceasta clasificare reprezinta o separare artificiala a diferitelor stari de soc care pot interfera sau se pot suprapune deoarece pacientii se pot afla simultan sub actiunea mai multor factori care actioneaza sinergic. Aceasta clasificare este urmatoarea:
Socul hipovolemic
Hemoragic:
prin traumatisme (hemoragie externa, interna, retro-peritoneala, sau intraperitoneala);
sangerare gastrointestinala.
Non-hemoragic:
deshidratare;
varsaturi;
diaree;
fistule;
arsuri;
poliurie (diabet insipid, cetoacidoza diabetica, insuficienta medulosuprarenaliana);
acumularea de fluide in "spatiul trei" (peritonita, pancreatita, ascita).
Socul cardiogen
Prin insuficienta de pompa a miocardului in:
infarctul acut de miocard (incluzand in afara de miocardul necrozat si miocardul siderat si hibernant);
contuziile miocardice;
miocardite (virale, autoimune, din parazitoze);
cardiomiopatii (de ex. hipertrofice, din amiloidoze, etc.);
depresii date medicamente sau toxice (β-blocante, blocante ale canalelor de calciu, antidepresive triciclice);
depresii miocardice intrinseci (in SIRS, in speta datorita factorilor depresori, in acidoza, hipoxie);
post cardiotomie sau post circulatie extra-corporeala (in chirurgia cardiaca).
Prin difunctii mecanice:
stenoze valvulare sau dinamice;
insuficiente valvulare;
defect septal ventricular;
defecte ale peretilor ventriculari sau anevrisme ventriculare.
Prin tulburari de ritm si/sau conducere:
tahiaritmii;
bradiaritmii;
blocuri atrioventriculare.
Socul extracardiac obstructiv
Prin compresie vasculara extrinseca:
tumori mediastinale.
Prin presiune intratoracica crescuta:
pneumotorax sub presiune;
ventilatie mecanica cu PEEP.
Prin obstructie vasculara intrinseca:
embolism pulmonar;
embolie gazoasa;
tumori;
disectie de aorta;
coartactie de aorta;
hipertensiune pulmonara acuta.
Prin afectiuni pericardice:
tamponada ( in traumatisme, ruptura de miocard, sindrom Dressler, in boli inflamatorii, autoimune, infectioase, maligne, in uremie sau in cursul unui tratament anticoagulant);
pericardita constrictiva.
Miscelanee (sindroame de hipervascozitate, criza de siclemie, policitemia vera).
Socul distributiv
in cadrul sindromului de raspuns inflamator sistemic (SIRS ) din:
●sepsis, soc septic (produs de bacterii, fungi, virusi, ricketsii);
●pancreatita , politraumatisme, arsuri;
Socul anafilactic / anafilactoid (veninuri, medicamente);
Socul neurogen (traumatisme medulare,anestezie spinala inalta)
Socul dat de substante toxice / medicamente (vasodilatatoare, benzodiazepine, etc.)
Socul endocrin (tiroidian din mixedem, insuficienta medulosuprarenaliana).
Aceasta abordare aparent simplista permite stabilirea rapida a unui diagnostic si adoptarea prompta a masurile terapeutice ce vizeaza restabilirea hemodinamicii, dovedindu-se in acest fel utila pentru perioada de debut a socului.
Pe de alta parte, trebuie inteles faptul ca afectarea initiala a uneia din componentele functionale ale sistemului cardiovascular declanseaza un complex de modificari fiziopatologice compensatorii care - prin interactiune cu natura si severitatea leziunii initiale, cu severitatea hipotensiunii arteriale, cu durata starii de soc, cu prezenta de coexistente patologice, cu rezervele fiziologice ale bolnavului si cu terapia aplicata - conditioneaza evolutia reala si prognosticul fiecarui bolnav in parte. In consecinta, pentru a avea o eficacitatea maxima, masurile terapeutice trebuie sa fie adresate atat cauzei initiale - deci componentei hemodinamice initial perturbate - cat si tuturor componentelor hemodinamice si metabolice perturbate ulterior, care pot evolua progresiv si independent de cauza.
In acest context, factorul timp capata o dimensiune extrem de importanta in evaluarea si tratamentului socului.
Elemente noi de fiziopatologia socului
In figura 1 se evidentiaza faptul ca in fiziopatologia socului un rol central il au mecanismele care controleaza fluxul sanguin regional. Fluxul sanguin la nivel de organ este dependent de presiunea de perfuzie si de rezistenta vasculara a vaselor care il iriga. Hipoperfuzia si disfunctia de organ apar daca rezistenta vasculara nu poate compensa scaderea presiunii sistemice de perfuzie sau daca presiunile sistemice nu pot depasi nivelele inalte ale rezistentei date de vasele care iriga organul respectiv. La disfunctia de organ pot contribui factori care actioneaza asupra microcirculatiei (in speta asupra perfuziei la nivel celular). Dintre acesti factori fac parte compresia microvasculara datorita edemului celular si alterarile vasomotricitatii datorita eliberarii de substante vasoactive. Factorul declansator primordial comun este perfuzia tisulara ineficienta pentru a satisface necesitatile metabolice ale celulelor.
Rolul rezistentelor vasculare sistemice si a distributiei fluxului sanguin
Socul septic este caracterizat prin rezistente vasculare sistemice indexate (RVSI) scazute, tendinta la hipotensiune si flux sanguin inadecvat necesitatilor tisulare (debit cardiac crescut dar maldistribuit). Daca scaderea RVSI ar fi cauza patogenica a socului septic,cresterea/normalizarea RVSI prin administrarea de vasopresoare ar trebui sa se coreleze cu imbunatatirea prognosticului fapt nedemonstrat. Din contra, vasopresoarele intensifica maldistributia fluxului sanguin. Nici RVSI scazute nu se coreleaza cu decesul.
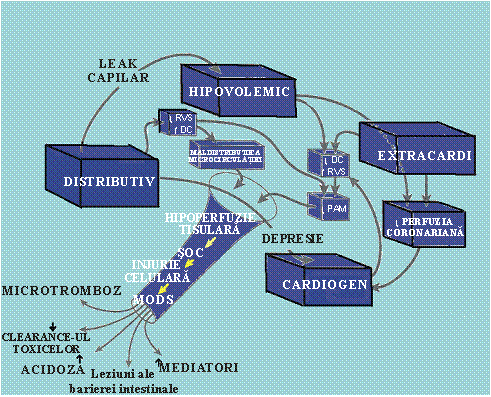
Fig. 1. Mecanismele care controleaza fluxul sanguin regional in fiziopatologia socului.
Valoarea scazuta a RVSI nu este o buna masuratoare a "socului distributiv" deoarece acestea reprezinta doar raspunsul presional la flux si nu distributia fluxului(RVSI = TAM /IC). Deoarece RVSI sunt direct corelate cu indexul cardiac adica cu fluxul total sanguin al organismului, acestea nu reflecta maldistributia fluxului in microcirculatie. Circuitele vasculare ale diverselor organelor sunt in paralel, iar rezistenta intregului sistem este mult influentata de circuitul cu cea mai mica rezistenta. Astfel, daca rezistenta dintr-un singur organ scade, in timp ce in toate celelalte organe creste, rezistentele vasculare totale calculate sunt scazute. Deci RVSI nu sunt o buna masura pentru tonusul arteriolar sau a distributiei fluxului sanguin la nivel de microcirculatie si nu sunt un criteriu potrivit pentru terapie. Totusi vasopresoarele sunt indicate in terapia socului septic (dupa optimizarea volemiei) deoarece hipotensiunea severa scade dramatic flxul sanguin coronarian si cel cerebral sunt dependente de presiunea de perfuzie.
Exista desigur riscul ca efectul ά-adrenergic sa exacerbeze vsoconstrictia neselectiva si sa agraveze maldistributia fuxului sanguin la nivel microcirculator.
Vasopresoarele utilizate cel mai fercvent in socul septic (noradrenelina,dopamina, adrenalina) au insa si efect inotrop pozitiv, deci vor creste si indexul cardiac iar efectul global asupra perfuziei/oxigenarii tisulare va depinde de reportul intre efectul pozitiv al cresterii fluxului sanguin si efectul negativ al maldistributiei.
Doza optima de vasoconstrictor este cea mai mica doza necesara mentinerii unei presiuni arteriale satisfacatoare.
Rolul hipoxiei tisulare in aparitia insuficientei de organ si a decesului
Perfuzia tisulara inadecvata fie ea cu flux scazut sau crescut duce la hipoxie tisulara, care daca este importanta si extinsa in timp produce disfunctie de organ, insuficienta (multipla) de organ si deces. Multe decese dupa chirurgie, trauma, sepsis sunt precedate de insuficienta multipla de organe, cea mai frecventa cauza de deces in T.I.
Cand manifestarile precoce ale socului sunt corectate prin terapie insuficienta, printr-o corectare proasta a oxigenarii tisulare, datoria de O2 rezultata poate sa nu fie recunoscuta pana la aparitia insuficientei de organ incluzand ARDS, sepsis, insuficienta acuta cardiaca, insuficienta renala, CID, insuficienta hepatica si coma.
Rolul alterarii permeabilitatii capilare in soc
In stadiile tardive al socului aratǎ cresterea apei totale si a apei interstitiale cu contractia volumului plasmatic si a lichidului intracelular. Prezenta unei cantitati foarte mari de apǎ interstitialǎ si totalǎ in organism nu insemna cǎ deficitul de volum sanguin a fost corectat deoarece hipovolemia apare frecvent in prezenta edemelor periferice masive. Cresterea de volum a interstitiului nu contribuie direct la disfunctia circulatorie, dar poate agrava problema transportului de O2 prin cresterea spatiului de difuziune a acestuia care traverseaza din spatiul intravascular spre membrana celularǎ.
Leakul capilar apare in stadiul tardiv al socului septic si mai putin frecvent in socul postoperator, traumatic si hemoragic. Se caracterizeaza prin hipovolemie persistentǎ in ciuda administrarii adecvate de lichide si prin edeme periferice importante. Leakul prin membrana capilarǎ duce la trecerea proteinelor plasmatice si a apei in interstitii. In stadiul tardiv edemele se pot agrava in efortul mentinerii volumului plasmatic.
Se considerǎ cǎ hipoxia tisularǎ localǎ si acidoza in asociere cu mediatorii biochimici initiaza leakul capilar. Cresterea cantitatii de lichid interstitial este probata de o progresie continuǎ a edemelor periferice. Restabilirea volumului sanguin in stadiul timpuriu al socului cu mentinerea ulterioarǎ a volumului intravascular este cea mai bunǎ profilaxie a acestui fenomen; acestea depind de presiunea oncoticǎ plasmaticǎ precum si de administrarea promptǎ de o cantitate adecvatǎ de lichide intravenos. Leakul capilar trebuie diferentiat de supraincarcarea cu lichide legatǎ de expansiunea excesivǎ a interstitiului cu mari cantitati de cristaloizi, care cresc foarte mult spatiul interstitial si restabilesc volumul plasmatic doar temporar.
Distributia fluidelor administrate intre plasmǎ si apa interstitialǎ in timpul resuscitarii cristaloide trebuie considerate separat de fenomenul de leak capilar. Leakul capilar, hipervolemia si infuzia masivǎ de cristaloide expandeazǎ spatiul interstitial, si pot duce la aparitia edemului pulmonar si periferic, dar prin mecanisme diferite. Leakul capilar apare cand permeabilitatea capilarǎ crescuta permite proteinelor plasmatice sǎ treaca in spatiul intravascular in cantitati ce compromit mentinerea volumului plasmatic. Edemul pulmonar produs prin hipervolemie sau insuficientǎ cardiacǎ se caracterizeaza prin PCP ridicatǎ (mai mare de 20 mm Hg) apa plasmaticǎ trecand in interstitiu datorita presiunii hidrostatice mari. Prin contrast, apa interstitialǎ pulmonarǎ in cantitate mare poate fi produsǎ ocazional dupa infuzie masivǎ de cristaloide, in timp ce PCP este relativ normalǎ, deoarece 80 % din cristaloizii administrati au parasit spatiul intravascular la sfarsitul primei ore de infuzie, iar peste inca o ora aproape tot restul a parasit spatiul intravascular si a intrat in cel interstitial.
Prezenta edemului pulmonar nu inseamna neaparat cǎ existǎ supraincǎrcare volemicǎ. Edemul pulmonar si cel periferic pot fi produse prin insuficientǎ cardiacǎ, valori scazute ale proteinelor prin malnutritie, insuficientǎ renalǎ, hepaticǎ, status hipermetabolic, traumatisme craniene, reactii anafilactoide, hipertermie, precum si in carcinomatozǎ si alte stari terminale.
Leakul capilar apare in perioada intermediarǎ, (ziua 3-5 postoperator) la pacientii post-soc, septici si atinge un maxim in faza tardivǎ sau terminalǎ.
In stadiile tardive de soc insotite de leak capilar nu existǎ decat o minimǎ crestere a DO2 si nici o imbunatatire a VO2 dupa administrarea de lichide si stimulare inotropǎ. Dimpotriva, in faza postoperatorie imediatǎ (primele 48 de ore) existǎ o imbunatatire semnificativǎ a ambelor variabile la administrarea de lichid si inotrop.
Injuria celulara
Socul afecteaza organele alterand integritatea functionala a celulelor constituente. Pentru a functiona normal celulele necesita energie. Injuria celulara este data de un deficit in livrarea substratului energetic, de o incapacitate de a utiliza nutrientii livrati, sau de incapacitatea de a produce energie din ei. Hipoperfuzia scade livrarea de nutrienti. Incapacitatea de a utiliza nutrientii livrati poate fi o consecinta secundara a hipoperfuziei, poate fi un efect toxic direct al unui agent nociv, sau poate fi mediata de citokine sau de modificarile metabolice de la nivel celular.
Perfuzia deficitara este procesul declansator. Pe masura ce scade livrarea de oxigen si de alti nutrienti scade productia de ATP. Se produce o incetinire a proceselor de mentinere a integritatii membranelor celulare. Prima manifestare la nivel ultrastructural a leziunii hipoxice este umflarea reticulului endoplasmic.
Apoi sunt afectate sunt mitocondriile prin condensarea compartimentului interior urmata de umflarea progresiva a mitocondriei. Pe masura ce se mentine hipoxia celulara are loc distructia lizozomilor cu eliberarea enzimelor lizante care contribuie la digestia intracelulara si la depunerea intracelulara de calciu. Distructia lizozomilor poate fi punctul care marcheaza ireversibilitatea leziunii celulare, analog cu ireversibilitatea clinica. Dupa acest moment recuperarea functiei normale de aprovizionare cu nutrienti nu mai poate impiedica moartea celulara.
Alt mecanism de injurie celularǎ il constituie formarea de radicali liberi datoritǎ efectului de reperfuzie sau datoritǎ activarii neutrofilelor. Acumularea produsilor de degradare ai ATP-ului (hipoxantine) in perioada de hipoperfuzie potenteaza activitatea enzimei xantin-oxidazǎ, iar pe masura ce are loc procesul de reperfuzie se produce din nou livrarea de oxigen in tesutul afectat. In acest moment oxigenul este convertit in radicalul activ superoxid (O2 ) , care la randul lui genereaza alte specii reactive cum ar fi peroxidul de hidrogen (H2O2) si hidroxil (OH ), contribuind la leziunile ultrastructurale ale membranei si la potentiala ireversibilitate (18). Neutrofilele activitate genereaza deasemenea cantitati mari de superoxid si enzime proteolitice care contribuie la injuria celularǎ. Hipoxia tisularǎ precipitǎ sau determinǎ activarea unor cascade ce implicǎ produsi ai acidului arahidonic - tromboxani (Tx), prostaglandine (PG), leucotriene (LT); histaminǎ si alte amine, serotoninǎ, sistemul complement, TNF (tumoral necrosis factor) si alte citokine, iar prin macrofagele activate elaborarea continuǎ de antigene bacteriene, mesageri intercelulari, radicali liberi de oxigen. Acesti mediatori produsi in patul capilar acidotic si hipoxic par sǎ initieze sau sǎ intensifice ARDS si alte insuficiente de organ .
In soc hipoxia localǎ tisularǎ stimuleaza eliberarea de peptide neuroendocrine, hormoni, proteine de fazǎ activǎ care modificǎ functia celulelor T si B, precum si a factorilor imunosupresivi. Celulele T activate si alte celule hematopoetice produc diverse citokine, inclusiv TNF si interleukine (IL 1, 2, 6, 8) . Limfocitele si monocitele activate au receptori pentru hormoni si pot sintetiza si secreta simultan aceiasi hormoni si mesageri. Activarea leucocitelor prin acestia sau prin alte mecanisme biochimice produc radicali liberi ai oxigenului, care desi au timp de viata scurt, produc leziuni tisulare majore.
S-a demonstrat cǎ nivelele plasmatice ale IL 1, 6, 8 si TNF cresc in cateva ore de la inducerea unei endotoxinemii si dupa perfuzia intravenoasǎ de bacterii . S-a demonstrat clinic si experimental activarea IL 6, 8 si TNF in sepsis sau ARDS dupa traumǎ . Eliberarea crescuta a fiecaruia dintre aceste citokine s-a asociat cu reactia de fazǎ acutǎ si status hipermetabolic .
Secventa modificarilor fiziopatologice legate de activarea citokinelor, complementului si a altor mediatori nu este inca elucidatǎ. Probabil cǎ aceste citokine, complementul si radicalii liberi ai oxigenului joacǎ un rol important in modularea alterarii metabolismului O2 si parametrilor hemodinamici asociati socului si sepsisului. Nivelul plasmatic al IL 6 si 8 atinge maximul la 16 ore dupa ARDS posttraumatic, dar modificarile hemodinamice si ale transportului de O2 apar inaintea ARDS.
Socul hipovolemic
Definitie
Socul hipovolemic este produs de reducerea volumului sanguin circulant efectiv, care determina scaderea debitului cardiac, scaderea fluxului sanguin periferic si deci reducerea marcata a aportului din oxigen la nivel tisular.
Existand mai multe cauze care pot produce scaderea volumului sanguin, se descriu mai multe forme de soc hipovolemic:
Socul hemoragic. Se caracterizeaza prin pierderea de sange asociata cu o leziune tisulara minima. Este forma de soc hipovolemic pur, in care modificarea fiziopatologica initiala este scaderea volumului intravascular. Exemple de soc hemoragic: plagi vasculare, ruptura de varice esofagiene, ruptura de sarcina extrauterina etc.
Socul traumatic. Scaderea volumului sanguin circulat efectiv prin pierderi de sange exteriorizate sau sechestrate in spatii nefunctionale, reprezinta perturbarea hemodinamica initiala ce caracterizeaza socul traumatic. Spre deosebire de socul hemoragic pur, in socul tramuatic hipovolemia este de la inceput asociata cu o distructie tisulara mare. Distructia tisulara extinsa produce o reactie inflamatorie locala si sistemica de amploare, cu aparitia locala si sitemica a unui mare numar de mediatori. Aceasta particularitate justifica paternul hemodinamic si metabolic al socului tramatic.
Socul prin pierderi de apa si electroliti. Pierderile de apa si electroliti prin varsaturi, aspiratie gastrica, diaree sau sechestrarea de apa si electroliti prin ocluzie intestinala, pot produce soc hipovolemic.
Socul prin arsuri. Arsurile extinse pot produce soc hipovolemic prin sechestrarea de plasma in spatiul extracelular extravascular nefunctional, Particularitatile socului prin arsuri constau in: (1) distrugere tisulara extinsa si raspuns inflamator precoce cu toate consecintele actiunii mediatorilor inflamatiei si (2) infectie frecvent asociata pe parcursul evolutiei cu posibilitatea de aparitie a socului septic.
Fiziopatologie
Scaderea volumului sanguin circulant produce o serie de modificari compensatorii sau decompensatorii, care se manifesta prin perturbari hemodinamice si metabolice.
Modificari hemodinamice
Scaderea volumului sanguin determina la nivelul macrocirculatiei in primul rand activarea baroceptorilor de joasa presiune localizati la nivelul atriilor si venelor mari. In consecinta, pe cale reflexa se produce venoconstrictia sistemica. Aceasta realizeaza mentinerea temporara a unei intoarceri venoase normale si reprezinta un mecanism compensator imediat extrem de eficient al hipovolemiei.
Continuarea scaderii volumului sanguin activeaza ulterior baroceptorii de inalta presiune de la nivelul sinusului carotitian si arcului aortic, prin intermediul carora se declanseaza reflex reactia sistemica simpato-adrenergica, materializata prin eliberarea de catecolamine de la nivelul terminatiunilor nervoase simpatice si de la nivelul medulosuprarenalei. Catecolaminele actioneaza pe receptorii adrenergici de la nivelul sistemului cardiovascular si produc redistributia regionala a fluxului sanguin, o adevarata 'centralizare a circulatiei' (dirijarea fluxului sanguin preferential spre cord si creier). Arginin-vasopresina si angiotensina eliberate in cadrul raspunsului la agresiunea realizata de hipovolemie participa, alaturi de sistemul adrenergic, la redistributia regionala a fluxului sanguin.
Redistributia regionala a fluxului sanguin are, pe de o parte, un rol benefic prin asigurarea temporara a supravietuirii, iar pe de alta parte, reprezinta cauza disfunctiilor/leziunilor la nivelul organelor 'sacrificate' din teritoriile cu vasoconstrictie ( splahne, muschi scheletici, piele).
Reactia hipodinamica, descrisa la nivelul macrocirculatiei desi reuseste sa intarzie deteriorarea hemodinamica grava a circulatiei in organele vitale, nu corecteaza deficitul de flux sanguin datorita relatiei existente intre fluxul sanguin, presiunea arteriala si rezistenta vasculara [Fluxul (debitul) = Presiune / rezistenta].
Astfel, reactia hipodinamica va tinde ca prin cresterea rezistentei vasculare sistemice sa mentina constanta presiunea cu pretul variabilitatii fluxului.
In fiziologia umana insa factorul determinant pentru buna functionare a unui organ este fluxul sanguin, dar sistemul cardiovascular uman nu poseda receptori de flux, ci doar baroreceptori care tind sa mentina o anumita presiune.
In final, ischemia celulara poate facilita reactii de tip umoral si proinflamator cu eliberare de mediatori (citokine, oxid nitric,etc.) care vor agrava tulburarile circulatorii ducand in final la leziune de organ si moarte.
La nivelul microcirculatiei se produc mai multe perturbari care se agraveaza progresiv :
1.Perturbarea schimburilor lichidiene la nivel capilar.
In mod fiziologic schimburile intre capilare si tesuturi sunt guvernate de legea Starling-Landies care afirma ca aceste schimburi sunt determinate de valorile presiunilor hidrostatice (care tind sa trimita apa in afara compartimentului respectiv) si ale presiunilor coloid-osmotice (care tind sa atraga apa in compartimentul respectiv), conform ecuatiei de mai jos:
Fn = k [ (Phc - Phi) - ∆ (Poc -Poi)]
unde: Fn este fluxul net (dinspre capilar spre tesut sau dinspre tesut spre capilar);
Phc = presiunea hidrostatica capilara;
Phi = presiunea hidrostatica interstitiala;
Poc = presiunea coloid-osmotica capilara;
Poi = presiunea coloid-osmotica interstitiala;
K = constanta dependenta de suprafata si particularitatile sistemului capilar;
∆ = coeficientul de reflexie care indica permeabilitatea pentru macromolecule (proteine):
[ ∆ = 0 membrana total permeabila la proteine];
[ ∆ = 1 membrana total impermeabila la proteine].
In mod fiziologic la capatul arteriolar:
Phc = 32 mm Hg.
Phi = 3 mm Hg.
Poc = 25 mm Hg.
Poi = 5 mm Hg.
Deci in sensul trecerii apei din capilar spre interstitiu actioneaza o forta (Phc+Poi) egala cu 32 mm Hg + 5 mm Hg = 37 mm Hg.
In sensul trecerii apei spre capilar din interstitiu actioneaza o forta (Poc + Phi) egala cu 25 mm Hg + 3 mm Hg = 28 mm Hg.
Astfel la capatul arteriolar rezulta o forta efectiva de filtrare (37 mm Hg - 28 mm Hg) de 9 mm Hg si apa trece din capilar in interstitiu.
La capatul venular insa: Phc = 17 mm Hg
Phi = 3 mm Hg
Poc = 25 mm Hg
Poi = 5 mm Hg
In sensul trecerii apei spre interstitiu actioneaza o forta de (17 mm Hg + 5 mm Hg) 22 mm Hg, in timp ce in sensul trecerii apei spre capilar actioneaza o forta de (25mm Hg + 3 mm Hg) 28 mm Hg. Rezulta astfel o forta efectiva de resorbtie de 6 mm Hg si apa trece din interstitiu in capilar.
Altfel spus: Fn la capatul arteriolar este 9 mm Hg (∆ Ph > ∆ Po);
Fn la capatul venular este -6 mm Hg (∆ Ph < ∆ Po).
Se observa totusi ca exista in cifre absolute o diferenta de 3 mm Hg intre forta efectiva de filtrare si forta efectiva de resorbtie, motiv pentru care la capatul venular se resoarbe numai 90% din apa filtrata la capatul arteriolar, restul de 10% trecand in circulatia limfatica(1).
Spre deosebire de situatia fiziologica descrisa mai sus,in cursul reactiei si socului hipovolemic, in prima etapa (venoconstrictie) nu au loc modificari importante, dar in urmatoarea etapa, de arterioloconstrictie si redistributie are loc o scadere a presiunii hidrostatice capilare pana chiar la realizarea relatiei: ∆ Ph < ∆ Po, cu inversarea fluxului (din interstitiu spre vas : lichidul din spatiul extracelular patrunde in vas si contribuie la refacerea volumului sanguin) si aparitia fenomenului de umplere transcapilara (fenomen compensator la hipovolemie, care poate readuce in vas pana la 2000 ml in 2 ore).
Daca insa cauza generatoare a socului hipodinamic persista, odata cu accentuarea hipoxiei si acidozei tisulare locale, vasoconstrictia arteriolara va incepe sa diminueze progresiv in intensitate ("oboseala sfincterului pre-capilar") in timp ce venoconstrictia ramane inca puternica.
Acest dezechilibru intre tonusul vasomotor al celor doua extremitati ale capilarelor va produce:
cresterea Ph capilare in tot teritoriul capilar respectiv, cu posibilitatea aparitiei relatiei: ∆ Ph >>> ∆ Po;
in plus, intracapilar avem deja o presiune coloidosmotica scazuta prin dilutia provocata anterior prin umplere transcapilara.
Ambele tulburari locale descrise anterior vor produce o trecere a apei din capilar catre interstitiu: fenomenul de scurgere capilara. Se inchide astfel un cerc vicios in care hipovolemia necorectata genereaza la randul ei hipovolemie.
2. Fenomenul de sunt arterio-venos. Modificarile de complianta vasculara ce apar la nivelul sfincterului precapilar sub actiunea unor factor vasoactivi locali fac posibila traversarea rapida a sangelui printr-un teritoriu capilar si imposibilitatea schimburilor cu tesutul. In acest context diferenta arterio-venoasa in oxigen creste si apare fenomenul functional de sunt, ce caracterizeaza microcirculatia in starile de soc.
3.Maldistributia fluxului sanguin. In starile de soc, fluxul sanguin poate fi distribuit neuniform in cadrul aceluiasi teritoriu capilar. Aceasta distributie neuniforma este datorata actiunii selective a unor factori vasoactivi locali (vasoconstictori sau vasodilatori) si sta la baza aparitiei disfunctiilor si leziunilor ce apar la nivelul sistemelor de organe.
4.Modificari reologice. Vascozitatea sangelui la nivel capilar creste prin scaderea deformabilitatii hematiilor si agregarea acestora in lanturi care pot bloca circulatia capilara. Concomitent se produce si agregare plachetara urmata de eliberare de material tromboplastic si coagulare intravasculara care compromite teritoriul capilar respectiv.
5.Disfunctii/leziuni ale endoteliului capilar. Celule endoteliului capilar sunt structuri extrem de active, care sintetizeaza si elibereaza o multitudine de mediatori cu actiune autocrina sau paracrina si au capacitatea de a-si exprima molecule de adeziune pentru leucocite circulante. Modificarile hemodinamice de la nivelul microcirculatiei afecteaza functional si structural endoteliul capilar. Disfunctiile/leziunile endoteliului capilar induc perturbari similare la nivelul interstitiului si ulterior la nivelul celulelor tesutului dependent de microcirculatia respectiva.
Modificari la nivel celular metabolic
In conditii de hipoxemie metabolismul devine anaerob, rezultand o acumulare rapida de acid lactic si o dereglare progresiva a functiilor celulare, culimand cu distrugerea celulei. in conditii de hipozemie partiala, la reluarea perfuziei tisulare apar asa numitele 'leziuni de reperfuzie' produse in principal de radicali de oxigen liber. Leziunile de reperfuzie sunt in mare masura responsabile de aparitia sechelelor socului hipovolemic, sub forma unor disfunctii/leziuni ale diverselor organe (plaman, rinichi, cord, ficat, intestin, sistem nervos etc.).
Diagnostic
Diagnosticul initial de soc hipovolemic se stabileste pe baza datelor de istoric, care sugereaza cauza posibila a hipovolemiei si pe baza semnelor de reactie hemodinamica hipodinamica. Explorarea hemodinamica invaziva va evidentia triada :presiuni de umplere(PVC,PCP) mult scazute, IC scazut, RVS mult crescute.
Principii de tratament
Tratamentul etiologic adresat cauzei producatoare (de exemplu hemostaza chirurgicala).
Evaluarea functiei respiratorii si aplicarea de masuri terapeutice adecvate (mentinerea libertatii cailor aeriene, oxigenoterapie, ventilatie mecanica etc.)
REFACEREA VOLUMULUI SANGUIN CIRCULANT reprezinta prioritatea tratamentului hemodinamic al socului hipovolemic. Rapiditatea cu care se reface volumul sanguin circulant conditioneaza succesul tratamentului. Datorita acestui considerent, chiar si in situatia unui soc hemoragic, tratamentul hipovolemiei NU SE INCEPE NICIODATA CU SANGE, ci cu solutii electrolitice saline sau cu solutii macromoleculare.
In acest scop se pot utiliza :
- solutiile saline izotone (ser fiziologic, solutie Ringer, solutie Hartman) sau hipertone (CI Na 5,85%). Nu se poate practica refacerea volumului sanguin cu glucoza 5%, deoarece aceasta produce o scadere a osmolaritatii in spatiul extracelular si determina migrarea apei intracelular si agravarea implicita a perturbarilor de la acest nivel.
- solutii macromoleculare inlocuitoare de plasma. Pentru refacerea volemiei se utilizeaza in prezent derivatii de GELATINA, si HIDROXIETILAMIDONUL.
- dintre produsii derivati de sange, albumina 5% reprezinta solutia ideala de refacere a volemiei, dar costul ridicat si dificultatea de producere in cantitati suficiente inclina preferintele spre solutiile electrolitice sau spre inlocuitorii de plasma.
Refacerea transportului de oxigen. Se efectueaza prin administrarea de CONCENTRAT DE HEMATII (masa eritrocitara) resuspendate, care permite corectarea rapida a hematocritului la valoarea optima de 25-30% (Hb 8- 10g/dl.).
Utilizarea sangelui integral este rezervata doar hemoragiilor cataclismice.
Evaluarea si corectarea tulburarilor de coagulare. in situatia in care apar semne de coagulopatie de dilutie si consum : se procedeaza la refacerea concentratiei factorilor de coagulare prin administrarea de PLASMA PROASPATA CONGELATA (care contine, spre deosebire de sangele integral, toti factorii de coagulare) si refacerea numarului de trombocite prin administrarea de CONCENTRAT TROMBOCITAR.
Socul cardiogen
Definitie
Socul cardiogen are semnificatia unui deficit sever al functiei de pompa cardiaca care se caracterizeaza prin existenta triadei :
- hipotensiune arteriala severa (TA sistolica < 90 mm.Hg).
reducerea severa a debitului cardiac (index cardiac < 1,8 l/min/mp)
cresterea volumului de sange din ventriculul stang la sfarsitul diastolei (presiune capilara pulmonara : PCP > 18-25 mmHg)
Profilul hemodinamic al socului cardiogen este hipodinamic, identic cu cel al socului hipovolemic, cu excceptia presiunilor de umplere care sunt crescute in socul cardiogen. Hipotensiunea severa este "marker"-ul socului cardiogen.
Socul cardiogen reprezinta forma exterma de manifestare a insuficientei cardiace congestive acute (ICCac.) si se deosebeste clinic si hemodinamic de insuficienta cardiaca congestiva acuta prin prezenta hipotensiunii arteriale si amploarea extrema atat a scaderii debitului cardiac ( IC < 1,8 l/min/mp) cat si a cresterii presiunilor de umplere (PCP > 18-25 mmHg).
In ICC ac. IC = 1,9 - 2,5 l/min/mp iar PCP = 18-20 mm.Hg.
Cauzele capabile sa se produca soc cardiogen sunt:
a. insuficienta de pompa a miocardului in:
infarctul acut de miocard (incluzand in afara de miocardul necrozat si miocardul siderat si hibernant,dar si disectia de aorta daca include si ostiile coronare);
contuziile miocardice;
miocardite (virale, autoimune, din parazitoze);
cardiomiopatii (de ex. hipertrofice, din amiloidoze, etc.);
depresii date medicamente sau toxice (β-blocante, blocante ale canalelor de calciu, antidepresive triciclice);
depresii miocardice intrinseci (in SIRS, acidoza, hipoxie);
post cardiotomie sau post circulatie extra-corporeala (in chirurgia cardiaca).
b. disfunctii mecanice:
stenoze valvulare sau dinamice;
insuficiente valvulare;
defect septal ventricular;
defecte ale peretilor ventriculari sau anevrisme ventriculare.
S.C. apare in orice cicumstanta in care mai mult de 40% din ventriculul stang (VS) este nefunctional.
Cauza predominanta ca frecventa in etiologia SC este de departe infarctul miocardic acut (IM) : un IM de mari dimensiuni ( > 40% din ventriculul stang este nefunctional) sau chiar un IM mai mic aparut fie la un pacient cu un IM vechi intins sau fie la un pacient cu insuficienta ventriculara cronica stanga pre-existenta(fie de cauza cardiomiopatica fie de cauza valvulara).
In cazul pacientilor cadiomoipati sau valvulari poate fi vorba si de un IM embolic deoarece o buna parte dintre acesti pacienti sunt in fibrilatie atriala cronica(FA).
Nu in ultimul rand un IM de mici dimensiuni aparut la un pacient cu zone intinse de miocard siderat (stunned ) sau hibernant poate precipita S.C.
Prin urmare, consecintele unui IM depind de : marimea teritoriului miocardic afectat si ''terenul'' miocardic restant ( adica starea miocardului neafectat si a vaselor coronare neafectate de IM).
S.C. apare la 7-9 % din pacientii internati cu diagnosticul de IM,iar timpul mediu de aparitie dupa internare este de 4-5 ore, ceea ce face ca fereastra terapeutica sa fie excesiv de mica pentru unii pacienti.
In fiecare din aceste cazuri afectarea majora a functiei cardiace conduce la hipotensiune arteriala prin scaderea debitului cardiac insotita de cresterea presiunii capilare pulmonare.
Socul cardiogen se manifesta prin semne de soc hipodinamic:
semne de hipoperfuzie;
presiunea pulsului scazuta;
timp de umplere capilara prelungit;
la care se adauga
●semnele care sugereaza o suferinta cardiaca:
- cresterea presiunii venoase jugulare;
- edeme periferice;
- raluri crepitante la bazele pulmonare (echivalentul unei presiunii capilare > 18 mmHg):
- dureri precordiale;
- modificari ischemice pe ECG;
- Rx - profilul cardiac marit si semne de congestie pulmonara
● hipotensiune arteriala.
In absenta tratamentului sau in situatia cand leziunea generatoare nu poate fi corectata, hipoperfuzia tisulara severa reduce progresiv aportul de oxigen la nivel tisular, determinand rapid insuficienta organica progresiva si moarte.
Fiziopatologie
Scaderea debitului cardiac produce modificari neuroumorale (reactie simpatoadrenergica, eliberare de arginin-vasopresina, activarea sistemul renina-angiotensina-aldosteron) care determina : tahicardie,vasoconstrictie periferica si cresterea contractilitatii miocardice in masura in care exista rezerva contractila. Acest mecanism opereaza atat in insuficienta cardiaca congestiva cat si in socul cardiogen.
Ceea ce caracterizeaza socul cardiogen si il deosebeste de insuficienta cardiaca congestiva este hipotensiunea arteriala, care are semnificatia unei scaderi severe a debitului cardiac ce nu poate fi compensata de raspunsul neurohormonal.
In aceste conditii de hipoperfuzie tisulara, aportul de oxigen mult scazut perturba grav metabolismul celular si in lipsa tratamentului se instaleaza rapid insuficienta organica progresiva si moartea.
a. Cercul vicios al ischemiei miocardice
Disfunctia cardiaca aparuta in cursul S.C. este initiata de ischemia/infarctul miocardic dar ulterior disfunctia cardiaca va agrava ischemia si astfel se va creea spirala descendenta descrisa de Hollenberg, de fapt un cerc vicios : ischemia miocardica genereaza ischemie miocardica.
Astfel, ischemia/necroza miocardica care atinge un prag critic al masei musculare a VS(in jur de 40%) produce o insuficienta severa de pompa avand drept consecinta scaderea dramatica a volumului bataie(VB) si a debitului cardiac(DC) care produce hipotensiune care :
agraveaza ischemia miocardica;
initiaza reactia hemodinamica de tip hipodinamic cu vasoconstrictie (clasica reactie simpato-adrenergica) si centralizarea circulatiei .
Cresterea activitatii simpatice nu produce numai descarcare de catecolamine ci si activarea axului renina-angiotensina. Sistemul renina-angiotensina si vasopresina vor creste si ele tonusul vasomotor, in special in patul vascular mezenteric.
Angiotensina II va creste eliberarea de aldosteron si va avea drept consecinta retentia de apa si sare.
Vasoconstrictia, tahicardia si retentia de fluide vor agrava atat disfunctia sistolica cat si pe cea diastolica.
In plus, miocardul ischemic este rigid (disfunctie diastolica),iar aceasta scadere a compliantei miocardice produce : cresterea presiunii tele-diastolice al VS(PTDVS) si limitarea umplerii diastolice, deci congestie pulmonara care are drept consecinta hipoxemie si agravarea dezechilibrului intre aportul si necesitatile de O2 miocardice deci in final se agraveaza atat ischemia cat si disfunctia miocardica.
Intreruperea acestui cerc vicios al disfunctiei-ischemiei miocardice este de fapt scopul terapiei medico-chirurgicale a S.C.
b. Miocardul siderat ( stunned myiocardium ) si miocardul hibernant
Termenul de miocard siderat defineste disfunctia miocardica postischemica
a unui teritoriu, care persista in ciuda restaurarii unui flux coronarian normal,
dar a carui performanta se poate recupera complet.
Miocardul hibernant este un teritoriu disfunctional datorat unui flux coronarian extrem de scazut dar a carui functie se normalizeaza prin ameliorarea fluxului coronarian(hibernarea ar putea fi un raspuns de adaptare a functiei la flux si astfel se minimalizeaza efectele ischemiei / necrozei).
Ambele variante de miocard descrise anterior au deci un potential de rezerva contractila si raspund la stimulare catecolaminica, oferind o fereastra terapeutica (catecolamine plus suport circulator mecanic) pana la recuperarea acestor teritorii : miocardul hibernat prin revasculariztie iar cel siderat prin trecerea timpului.
c. Raspunsul inflamator sistemic (SIRS) in socul cardiogen
Observatia ca unii pacientii cu S.C. decedeaza in ciuda normalizarii debitului cardiac sub terapie si prezinta vasodilatatie periferica cu RVS scazute si maldistributie a fost recent documentata de catre Hochman care a aratat ca S.C. are drept consecinta si amorsarea unui sindrom de raspuns inflamator sistemic(SIRS
Pacientii cu infarcte miocardice extinse au deseori: leucocitoza, febra, precum si nivele crescute de interleukine, proteina C-reactiva, complement.
In cazul aparitiei SIRS, mediatorii inflamatiei activeaza si sinteza de oxid nitric (NO).
NO exercita un efect dependent de concentratie asupra miocardului:
nivelele mici de NO au efect cardioprotector: cresc contractilitatea miocardica si amelioreaza relaxarea diastolica;
nivelele mari de NO au un efect deletoriu: scad contractilitatea miocardica, altereaza respiratia mitocondriala, inhiba raspunsul la stimularea β-adrenergica si produce vasodilatatie sistemica.
Recunoasterea acestui nou mecanism implicat in socul cardiogen deschide deja prespective terapeutice noi legate de rolul inflamatiei si a NO.
Diagnostic
Diagnosticul de soc cardiogen se stabileste pe baza datelor de istoric (care sugereaza o suferinta capabila sa produca scaderea performantelor pompei cardiace) corelate cu hipotensiune arteriala plus semne de soc hipodinamic si semne de incarcare cardiaca excesiva (cord 'prea plin').
Hipotensiunea arteriala diferentiaza socul cardiogen de insuficienta cardiaca congestiva acuta.
Certitudinea de diagnostic este data de monitorizarea hemodinamica invaziva (cateter Swan-Ganz) care permite evaluarea exacta a debitului cardiac si a presiunii capilare pulmonare si constituie in acelasi timp o modalitate obiectiva de urmarire a tratamentului. Echocardiografia este o metoda complementara, si extrem de utila atat in precizarea cauzei socului cardiogen cat si in evaluarea ulterioara.
Principii de tratament
A.. Tratamentul cauzei conditioneaza succesul terapeutic. In conditiile in care cauza determinanta poate fi solutionata, sansele de recuperare cresc semnificativ (ex. tratamentul chirurgical al unei leziuni valvulare acute, evacuarea unui revarsat pericardic,revascularizarea de urgenta in socul cardiogen din infarctul de miocard).
In situatia unui soc cardiogen determinat de un infarct miocardic (circa 7% din bolnavii internati cu infarct miocardic acut) prognosticul ramane rezervat(mortalitate 40-80 %), fiind dependent de suprafata de miocard functional pierduta precum si de posibilitatile terapeutice ale institutiei medicale in care ajunge pacientul.
B. Tratamentul socului cardiogen consecutiv infarctului de miocard
1. Terapie generala si imediata
a. oxigenoterapie
b.tratamentul durerii ( morfina 1-2-5 mg.iv.)
c. tratamentul imediat al aritmiilor severe
d. administrarea de VASOPRESOARE
Obiectivul principal imediat in terapia intensiva a socului cardiogen il constituie mentinerea unei presiuni arteriale minime necesare pentru asigurarea unui flux sanguin coronarian si cerebral adecvat supravietuirii.
Mijloacele farmacologice clasice cuprind substante vasoconstrictoare, dintre care noradrenalina (administrata in perfuzie endovenoasa continua10-200 micrograme/kg/minut) ramane inca cea mai utilizata dar se mai pot utiliza fie dopamina in doze mari (>15 micrograme/kg/minut) fie neosinefrina .
e. administrarea de inotrop pozitive de tip simpatomimetic (dobutamina 5-20 micrograme/kg/minut, dopamina 10-15 micrograme/kg/minut sau adrenalina 50-500 micrograme/kg/minut ) sau sensibilizatori de calciu ( Levosimendan).
f. suportul circulator mecanic : utilizarea balonului de contrapulsatie intra-aortica (in toate cazurile in care cauza socului cardiogen este potential reversibila cu excceptia asocierii insuficientei aortice). Balonul de contrapulsatie se introduce percutan prin artera femurala pana in aorta descendenta imediat dupa emergenta arterei subclaviculare stangi. Plasat la acest nivel, balonul se umfla in diastola (crescand perfuzia coronariana si cerebrala) si se dezumfla inaintea debutului sistolei (scade postsarcina).
Din nefericire aplicarea tuturor masurilor terapeutice enuntate anterior nu au reusit sa scada mortalitatea acestor pacienti sub 80 %.
2. Terapia etiopatogenica
Terapia etiopatogenica este cea care a schimbat prognosticul pacientilor cu soc cardiogen consecutiv infarctului de miocard (mortalitate 40-50 %) si este reprezentata de revascularizatia miocardica de urgenta .
Revascularizatia miocardica de urgenta se poate efectua prin urmatoarele metode:
angioplastie coronariana transluminala percutana cu stent (PTCA) este metoda de electie
tromboliza medicamentoasa fibrinolitica
revascularizatie chirurgicala : by-pass coronarian sub circulatie extracorporeala de urgenta
3. Terapia complicatiilor mecanice ale infarctului miocardic complicat cu soc cardiogen ( defect septal interventricular,insuficienta mitrala acuta,ruptura cardiaca) este esentialmente chirurgicala.
Socul septic
Definitie
Socul septic este socul care apare ca rezultat al efectelor sistemice ale infectiei. Socul septic reprezinta a doua etiologie cel mai des intalnita la bolnavii chirurgicali. Mortalitatea prin soc septic este inca foarte crescuta (>50%) cu toate progresele facute in intelegerea mecanismelor de producere.
Pentru a defini socul septic este necesar sa precizam cateva notiuni semantice care au fost stabilite in 1992 intr-o conferinta de consens a Colegiului american al chirurgilor toracici impreuna cu Societatea Americana de Terapie Intensiva.
INFECTIA este raspunsul inflamator determinat de prezenta microorganismelor invadatoare la nivelul unor tesuturi ale gazdei, care sunt in mod obisnuit sterile. Particularitatile sunt terminate de calitatea microoganismelor implicate.
BACTERIEMIA viremia, fungemia etc., definesc simpla prezenta a microorganismelor viabile in sangele gazdei.
SINDROMUL DE RASPUNS INFLAMATOR SISTEMIC (SIRIS reprezinta modalitatea de raspuns nespecific a gazdei la orice trauma (injurie) severa. Se manifesta prin:
Temperatura > 38oC sau < 36oC;
Tahicardie >90 batai/minut;
Tahipnee >20 respiratii/minut sau PaCO2 < 32 mmHg;
Leucocite >12.000/mm2, leocucite < 4.000 sau > 10% forme imature.
SEPSISUL este considerat RASPUNSUL INFLAMATOR SISTEMIC determinat de prezenta unui proces infectios activ in organismul gazda.
Acest raspuns declansat de infectie nu este dependent de calitatea microorganismelor ce produc infectia, fiind determinat exclusiv de calitatile organismului gazda care elaboreaza raspunsul.
In esenta, notiunea de sepsis se suprapune integral notiunii de SRIS, atat din punct de vedere patogenic cat si manifestare generala (vezi semnele de SRIS).
Se mentine individualizarea separata a raspunsului inflamator sistemic la infectie, datorita faptului ca in acest cadru au fost identificate mai multe forme de manifestare clinica, cu gravitate progresiv crescuta.
SEPSISUL SEVER defineste sepsisul asociat cu disfunctii organice.
SOCUL SEPTIC reprezinta sepsisul insotit de scaderea presiuni arteriale medii si semne de hipoperfuzie tisulara in conditiile unei volemii normale. Hipotensiunea arteriala poate lipsi la bolnavii cu medicamente inotrop pozitive si/sau vasopresoare. Simpla necesitate a utilizarii acestora la un bolnav normovolemic cu sepsis permite diagnosticul de soc septic.
Socul septic reprezinta asadar o forma grava de raspuns al gazdei la infectia produsa de o varietate de microorganisme: germeni gram pozitivi, germeni gram negativi, virusuri, micelii, ricketsii.
Fiziopatologie
Patogenia socului septic este comuna cu a sepsisului si a sindromului de disfunctii/leziuni organice multiple.
Patogenia extrem de complexa a raspunsului inflamator sistemic la infectie implica mecanismele de aparare ale gazdei, produsi ai microorganismelor invadatoare (exotoxine, endotoxine) si o multitudine de mediatori.
Mecanismele de aparare locale (sistem respirator, tract digestiv, tract genitourinar, piele) si mecanismele de aparare sistemice (imunitate umorala, imunitate celulara, imunitate nespecifica) ale organismului gazda sunt afectate in conditiile bolnavului critic, fie de boala, fie chiar de unele masuri terapeutice, crescand semnificativ riscul de infectie.
Toxinele microorganismelor invadatoare sunt exotoxine (ex.: exotoxinele stafilococului) si endotoxine (lipopolizaharid, parte componenta a portiunii externe a membranei celulare si germenilor gram negativi). Atat exotoxinele, cat si in mod special endotoxinele, sunt capabile sa declanseze activitatea a numeroase cascade de mediatori.
Mediatorii implicati in patologia sepsisului sunt mediatori celulari (leucocite, trombocite, celule endoteliale) si mediatori umorali (sistem de contact, sistemul complementului, sistemul prostanoid, sistemul fibrinolitic). In prezent sunt cunoscute mai mult de 100 de substante active, cu implicatii in patologia modificarilor hemodinamice si metabolice caracteristice sepsisului sever, socului septic si sindromului de disfunctii/leziuni organice multiple (ex.: interleukinele 1-14, factorul de necroza tumorala, factorul activator plachetar, proteaze, radicali liberi de oxigen, oxid nitric etc.).
Modificari hemodinamice
Reactia hiperdinamica este similara la nivelul macrocirculatiei cu reactia fiziologica la efort, dar se insoteste de afectarea microcirculatiei prin mecanisme variate (primare sau secundare leziunilor celulare metabolice).
Reactia hiperdinamica este un tip aparte de reactie a organismului la o agresiune de tip: germeni microbieni sau leziuni tisulare intinse (necroze, hematoame, micro-tromboze extinse, ischemie prelungita, trauma complexa, postoperator, etc.).
Germenii microbieni si leziunile tisulare sunt de fapt activatorii sindromului de raspuns inflamator sistemic (SIRS). Acestia sunt susceptibili de a produce eliberarea de mediatori specifici ai SIRS (prin activarea sistemului microendocrin leucocitar, a neutrofilelor, a sistemului complement, coagulare-fibrinoliza, prostanoid, opioid, nervos vegetativ, sistemul macroendocrin, etc.).
Reactia hiperdinamica este caracteristica atat sindromului de raspuns inflamator sistemic (SIRS),cat si sepsisului (SIRS plus infectie manifesta sau suspectata), sepsisului sever (sepsis plus cel putin o disfunctie de organ) sau socului septic.
Reactia hiperdinamica este un model fiziopatologic aparte dictat de catre necesarul metabolic celular foarte crescut, deci de un consum global de oxigen crescut (VO2) care necesita un transport global de oxigen crescut (DO2).
in plus, in cadrul SIRS si in cadrul sepsisului/socului septic modelul fiziopatologic special se manifesta si prin dependenta VO2 de marimea DO2, la valori mari ale DO2 la care in mod normal nu exista aceasta relatie de dependenta.
La nivelul macrocirculatiei, reactia hiperdinamica aparuta ca urmare a nevoilor metabolice crescute se manifesta prin cresterea debitului si a indexului cardiac (corespunzand consumului de oxigen crescut), cu cresterea debitului bataie si tahicardie. Performanta cardiaca este global crescuta (cresterea contractilitatii fiind evidentiata de cresterea ∆p/∆t, modificarea timpilor sistolici, scaderea perioadei de preejectie, etc.).
Tensiunea arteriala sistolica este fie normala, fie usor scazuta sau crescuta ne fiind modificata in mod caracteristic (cu exceptia socului septic in faze avansate), dar rezistenta vasculara sistemica este scazuta in mod semnificativ.
Presiunile de umplere (PVC, PCP) sunt normale sau usor/moderat scazute.
Trebuie mentionat ca asocierea hipovolemiei sau a afectarii miocardice in sepsisul sever sau socul septic, in lipsa unei terapii adecvate, (repletie volemica, respectiv administrarea de inotrop pozitive) vor evidentia o reactie hipodinamica si nu una hiperdinamica.
Bineinteles ca afectarea miocardica in sepsisul sever si socul septic avansat vor modifica presiunile de umplere (PVC, PCP) in sensul cresterii acestora.
Presiunile pulmonare nu sunt nici ele modificate in reactia hiperdinamica din SIRS si sepsis. Odata cu aparitia leziunilor pulmonare si cardiace din sepsisul sever si socul septic acestea cresc.
La nivelul microcirculatiei, datorita faptului ca la originea reactiei hiperdinamice se afla o leziune initiala la nivelul celulelor si vaselor periferice, modificarile vor fi intense si precoce, afectand grav endoteliul vascular si capilar.
Rolul afectarii microcirculatiei tuturor organelor (ca raspuns al organismului la actiunea mediatorilor) este crucial in evolutia spre vindecare sau deces in cursul socului hiperdinamic, iar leziunea decisiva se afla la nivelul interfetei capilar/interstitiu celular (inclusiv membrana bazala si structurile proteoglicanice).
In socul hiperdinamic (ca in toate formele de soc distributiv) pacientii dezvolta atat hipotensiune cat si maldistributie a fluxului sanguin.
Lezarea endoteliului capilar produce leak capilar si deci extravazarea volumului intravascular.
Rolul definitoriu al microcirculatiei in socul septic este sprijinit si de faptul ca "celularitatea" socului septic se explica prin faptul ca desi mediatorii SIRS, sepsisului si socului septic produc ei insisi leziuni celulare, leziunea celulara definitiva apare dupa o etapa intermediara, aceea a afectarii interfetei capilar/ interstitiu celular.
Reactia de tip hiperdinamic se manifesta prin:
tahicardie si scaderea presiuni arteriale medii
cresterea indexului cardiac;
scaderea rezistentei vasculare sistemice
presiuni de umplere ( PVC,PCP) normale sau usor scazute
scaderea contractilitatii miocardice (compensata tranzitoriu prin cresterea volumului);
rezistenta vasculara pulmonara initial normala, apoi crescuta chiar si in absenta hipoxemiei si acidozei;
perturbarea relatiei DO2/VO2.
Pana de curand s-a considerat ca in socul septic consumul de oxigen la nivel tisular (VO2), devine in mod anormal dependent de aport (DO2), ceea ce are semnificatia unui aport de oxigen global insuficient la nivelul tesuturilor.
Acest concept a condus la utilizarea in tratament a unui DO2 peste valorile normale. Studii mai recente nu au confirmat aceasta supozitie, dar au demonstrat existenta unor perturbari regionale ale aportului de oxigen, care sunt determinate de actiunea mediatorilor eliberati in cadrul sepsisului si nu pot fi evaluate prin aprecierea globala a DO2 si VO2, dar justifica aparitia maldistributiei fluxului sanguin si a disfunctiilor/leziunilor sistemice si organice.
Modificari metabolice
Suferinta celulara apare precoce in socul septic si se datoreaza actiunii paracrine si autocrine a meditatorilor eliberati in cadrul sepsisului. Reactia hemodinamica hiperdinamica este conditionata metabolic si se datoreaza fie unei dereglari ale fosforilarii oxidative, fie unei perturbari a utilizarii energiei stocate pe fosfatii macroergici.
Modificarile metabolice se manifesta prin aparitia disfunctiilor/leziunilor la nivelul sistemelor de organe (encefalopatice, insuficienta renala acuta, pulmon de soc etc.).
Diagnostic
Diagnosticul de soc septic se stabileste pe baza semnelor de reactie hemodinamica, asociate cu semnele de sepsis.
Principii terapeutice
Tratamentul socului septic cuprinde:
Masurile terapeutice adresate cauzei :
- tratamentul chirurgical de urgenta (cand este posibil) al sursei de infectie cu evacuarea/ drenarea focarelor septice si debridare tisulara
- antibioterapie : la inceput cu spectru larg dar luand in consideratie tabloul florei microbiene comunitare si de spital iar dupa 48-72 de ore, dupa eventuala identificare a germenilor antibioterapie "tintita" cu spectru mai ingust.
Terapia intensiva a perturbarii hemodinamice :
optimizarea volumului sanguin circulant si corectarea anemiei la un Ht optim de 30%
vasopresoare ( noradrenalina- de electie sau dopamina ) daca terapia volemica nu a restaurat tensiunea arteriala si perfuzia tisulara sau pana cand aceasta isi face efectul.
administrarea de droguri initrop pozitive pentru maximalizarea contractilitatii miocardice.
Terapia patogenica antimediatori.
Pentru a combate actiunea nociva a unor mediatori s-au incercat dealungu anilor metode nespecifice (hemofiltarea, corticoterapia) si metode specifice (anticorpi monoclonali: antiendotoxina, antiinterleukina 1, antifactor de necroza tumorala etc.). In lumina datelor actuale exista doar doua categorii de medicamente antimediatori care sunt capabile sa contribuie la scaderea mortalitatii in socul septic :
- Proteina C activata (Xigris)
- corticosteroizii in doze mici ( HHC 100mg. x 3 / zi) 5-10 zile.
4. Masuri terapeutice generale
a. analgezie-sedare
b. controlul glicemiei ( glicemie < 150 mg/dl)
c. protocol de nutritie enterala / parenterala
d. profilaxia ulcerului de stress ( agenti anti-H2, inhibitori pompa protoni)
e. profilaxia trombozelor venoase profunde (heparina nonfractionata sau cu molecula moleculara mica).
5. Tratamentul disfunctiilor/leziunilor organice
- tratamentul plamanului de soc (ARDS) : ventilatie mecanica
- tratamentul insuficientei renale acute : hemodializa / hemofiltrare.
- tratamentul disfunctiei cardio-vasculare : vasopresoare,inotrope,etc.
Socul anafilactic (Anafilactoid)
Definitie
Socul anfilactic si anafilactoid sunt forme de soc cu manifestare clinica si patogenie particulare.
Socul anafilactic are un mecanism imunologic, fiind determinat de o reactie acuta la o substanta straina la care organismul a fost in prealabil sensibilizat (hipersensibilizare imediata sau hipersensibilizare de tip I).
Socul anafilactoid este identic din punct de vedere al manifestarii clinice, dar nu este declansat de un mecanism imunologic.
Fiziopatologie
Sensibilizarea care produce reactii anafilactice (inclusiv soc anafilactic) apare dupa expunerea la o substanta alergogena, care singura sau impreuna cu o haptena, stimuleaza sinteza de imunglobina E (IgE) care se leaga de suprafata mastocitelor si bazofilelor. La urmatoarea expunere la antigen se produce o reactie antigen anticorp (IgE legat de suprafata celulei) care determina eliberarea de histamina si alti mediatori de la nivelul celulelor mastocitare (interuekine, prostaglandine, leucotriene, factor activator plachetar).
Reactiile anafilactoide (inclusiv socul) au aceeasi expresie clinica, dar mecanismul de declansare este inca incert. Substantele de contrast iodate si drogurile hipnotice intravenoase pot activa sistemul complementului. Reactiile la proteinele plasmatice si albumina par a fi induse de agregate de albumina sau de modificarea moleculelor de albumina. Reactiile la dextrani si gelatine pot fi activate de un anticorp non IgE deja prezent in plasma. Unele droguri, cum ar fi morfina, atracurium si vecuronium (substante relaxante musculare) sau Haemacelul (derivat de gelatina) au efecte directe asupra eliberarii de histamina, formele de manifestare clinice fiind legate de locul unde se elibereaza histamina (piele pentru morfina, plaman pentru atracurium si vecuronium).
Manifestarile cardiovasculare ale socului anafilatic si anafilacoid sunt identice: vasodilatatie, cresterea permeabilitatii capilare cu pierderea de plasma in spatiul interstitial, scaderea presarcinii (hipovolemie absoluta si relativa), scaderea debitului cardiac, tahicadie si hipertensiune arteriala severa brusc instalata.
Manifestarile cardiovasculare sunt asociate frecvent cu tulburari respiratorii severe (bronhospasm, obstructie laringiana) care agraveaza evolutia.
Tratament
Tratamentul insuficientei pulmonare
oxigenoterapie;
intubatia traheala;
suport ventilator artificial.
Adrenalina este medicatia de electie in tratamentul socului anafilactic (anafilactoid) datorita pe de o parte efectelor sale vasoconstrictoare (efect alfa 1), si cardiotonice (efect beta 1) care corecteaza perturbarile hemodinamice,capacitatii sale a inhiba eliberarea de histamina (efect beta 2), iar pe de alta parte datorita efectelor sale bronhodilatatoare (efect beta 2) care amelioreaza functia pulmonara.
Adrenalina se administreaza intravenos, in perfuzie continua (1-2 mg in 100 ml ser fiziologic) urmarind disparitia simptoamelor respiratorii si cadiovasculare.
In situatia unor manifestari anfilactice (anafilactoide) care nu sunt insotite de soc, adrenalina se poate administra subcutanat in doza de 0,3-0,5 mg.
Daca fenomenele de bronhospasm nu cedeaza la administrarea de adrenalina se pot administra: aminofilina 5-6 mg/Kg in perfuzie in 30 de minute, sulfat de magneziu, ketamina sau halotan (anestezic volatil).
Corticoizii, utilizati pe scara larga in practica, nu au efect imediat care sa fie util in corectarea tulburarilor severe respiratorii si cardiocirculatorii din socul anafilactic (anafilactoid) declansat, dar par a avea efect profilactic.
Antihistaminicele (anti H1 si H2) nu au efect in socul anafilactic (anafilactoid) declansat. La fel ca si corticoizii, antihistaminicele par a avea mai mult rol profilactic.
3. Pentru restabilirea volemiei se utilizeaza inlocuitori de plasma sau solutii electrolitice (vezi socul hipovolemic).
Socul neurogen
Definitie
Termenul de soc neurogen este folosit pentru a descrie hipotensiunea secundara unei disfunctii a sistemului nervos produsa de o trauma severa sau de o rahianestezie, accidental, prea inalta.
Fiziopatologie
Socul neurogen are ca mecanism principal de producere o disfunctie acuta a sistemului nervos vegetativ simpatic.
Hipotensiunea este determinata de simpaticoliza, care se produce fie aproape de origine (hipotalamus, trunchi cerebral), fie, mult mai frecvent, la nivelul maduvei cervicale sau toracale. In aceste conditii dispare tonusul simpatic rezultand vasodilatatie si scaderea rezistentei vasculare sistemice, insotite de cresterea capacitatii sistemului nervos si scaderea intoarcerii venoase,scaderea presarcinii si consecutiv a debitului cardiac urmata de hipotensiune severa .
Diagnostic
Diagnosticul se stabileste pe baza datelor de istoric, care sugereaza etiologia, (traumatica sau accident de anestezie spinala) si a datelor clinice (hipotensiune cu extremitati calde).
Principii de tratament
refacerea tonusului simpatic prin administrarea de droguri simpatomimetice vasoconstrictoare (efedrina, neosinefrina, noradrenalina);
mentinerea unui volum intravascular adecvat prin administrarea de solutii volemice.
|
Politica de confidentialitate | Termeni si conditii de utilizare |

Vizualizari: 4514
Importanta: ![]()
Termeni si conditii de utilizare | Contact
© SCRIGROUP 2025 . All rights reserved