| CATEGORII DOCUMENTE |
| Astronomie | Biofizica | Biologie | Botanica | Carti | Chimie | Copii |
| Educatie civica | Fabule ghicitori | Fizica | Gramatica | Joc | Literatura romana | Logica |
| Matematica | Poezii | Psihologie psihiatrie | Sociologie |
Echilibru de faza in sistem monocomponent
Termodinamica sistemelor eterogene studiaza transformarile dintre faze, stabilind conditiile de echilibru intre faze, domeniile de existenta ale fazelor in functie de temperatura si presiune, cum si domeniile de existenta sau coexistenta ale fazelor.
![]()
Echilibrul in sistem monocoponent, precum si conditia de echilibru descrisa
prin egalitatea potentialelor chimice, se pot reprezenta prin ecuatii de tipul:
![]()
(8.1)
Orice substanta pura se poate regasi in una din cele trei faze distincte: o faza solida, (cristalina, sau mai multe faze polimorfe), o faza lichida sau o faza gazoasa.
Echilibrul de faze se studiaza in reprezentari tridimensionale m-T-P.
Pentru un sistem monocomponent pot exista urmatoarele situatii:
q Sistemul are trei faze in echilibru, F C-P+2 = 0 , deci sistemul este invariant
q Sistemul are numai doua faze in echilibru, F C-P+2 = 1, deci sistemul este monovatiant;
q Sistemul are numai o singura faza, F C-P+2 = 2, sistemul este bivariant.
![]()
Sa
consideram un sistem monocomponent si monovariant,
pentru care conditia de echilibru impune:
![]()
![]()
Adica,
(8.3)
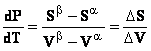
![]()
sau
Ecuatia (8.4) reprezinta ecuatia Clapeyron. Ea descrie variatia presiunii cu temperatura la echilibru intre cele doua faze. Aceasta ecuatie permite de asemenea construirea dependentei grafice a presiunii de echilibru in functie de temperatura de echilibru. Cazul general de rezolvare a ecuatiei (8.4) conduce la expresii de tipul:
![]()
Dintre ecuatiile presiunilor de vapori de larga circulatie se amintesc ecuatiile lui Kirchoff, Antoine, De Heen, Bernard, precum si ecuatiile reduse ale lui Riedel, Frost-Kolkwarf, Donald-Miller etc.
Ecuatia lui Antoine este cea mai utilizata expresie pentru calculul presiunilor de vapori ale sistemelor unicomponente, sub forma:
![]()
unde A si B sunt constante pentru caracteristice diferitelor corpuri. Ecuatia lui Antoine a fost dedusa din ecuatia Clausius-Clapeyron si da rezultate reproductibile cu datele experimentale pentru combinatii organice si nepolare.
In cazul tratarii echilibrelor de faza in sisteme unicomponente s-au semnalat unele regularitati cum sunt:
q Regula lui Ramsay si Young, fundamentata tot pe ecuatia lui Clausius-Clapeyron, care prevede ca raportul punctelor de fierbere a doua lichide, asemanatoare chimic, are aceeasi valoare la orice presiune.
q Regula lui Trouton care prevede ca entropia de vaporizare a lichidelor neasociate are aceeasi valoare, de circa 20 u.e. mol., la punctul lor normal de fierbere.
Diagrama de echilibru a apei este un exemplu al echilibrelor de faza in
sistem monocomponent. Coordonatele punctului triplu sunt: T = 273,16 K si
P = 4,585 mmHg, iar ale punctului critic sunt: Tc K, Pc = 218,3 atm. si Vc = 59,1 cm3 mol. Curba lichid-vapori poate fi extinsa sub punctul triplu pana la - 40 0C in stari metastabile de apa lichida subracita, vezi figura 7.2.
In studiul sistemelor unicomponente poate apare si fenomenul de
alotropie cristalina, sau polimorfism al unor solide diferit cristalizate. Acesta se refera la proprietatea unor solide de a coexista sub doua sau mai multe forme cristaline. Transformarea reversibila a unei forme cristaline in alta, la temperatura de transformare, constituie fenomenul de enantiotropie. Transformarea ireversibila a unei forme cristaline in alta forma cristalina, la temperatura de transformare, constituie fenomenul de monotropie. Fenomenul de monotropie este foarte greu de urmarit. Un exemplu il constituie diamantul si grafitul, forma stabila fiind grafitul.
Exista si posibilitatea trecerii de la enantiotropie la monotropie si invers la presiuni suficient de ridicate cand pozitiile curbelor de transformare se inverseaza. Ca exemplu, sulful enantiotrop in conditii obisnuite, devine la presiuni peste 1400 atm., monotrop, singura forma stabila fiind forma rombica.
Un alt fenomen care se poate intalni in studiul sistemelor unicomponente il reprezinta mezomorfismul. Starile mezomorfe reprezinta stari intermediare intre starea solida cristalizata si starea lichida. Mezomorfismul a fost pus in evidenta prin existenta unei anizotropii, la unele corpuri lichide, intr-un interval relativ extins de temperaturi.
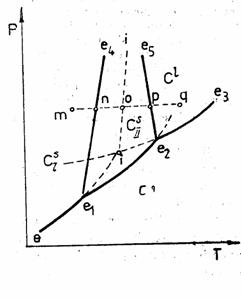
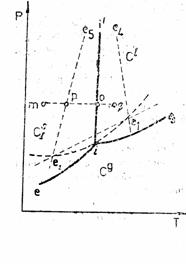
Figura 8.1 Enantiotropie Figura 8.2 Monotropie
Astfel, pentru unele corpuri organice s-a pus in evidenta urmatoarea suita de stari: starea cristalina, starea smectica (lamelate, de obicei vascoase), starea nematica sau filamentoasa (cristale lichide, de obicei fluide) si starea lichida. Domeniile de stabilitate care corespund acestor stari sunt delimitate de temperaturi de transformare.
|
Politica de confidentialitate | Termeni si conditii de utilizare |

Vizualizari: 2317
Importanta: ![]()
Termeni si conditii de utilizare | Contact
© SCRIGROUP 2026 . All rights reserved